Introduction
chain 중합은 reactive species 에 의해 개시된다. 이 은 개시제 로부터 만들어진다. reactive species는 monomer에 붙어 결합을 open하여 새로운 reactive center를 만들어 중합 반응을 계속적으로 이어나간다. 이때 reactive species가 radical이면 radical chain 중합, cation이면 cation chain 중합, anion이면 anion chain 중합이다.
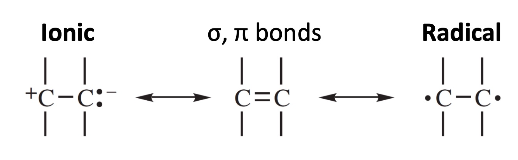
위 그림과 같이 chain 중합에서 개시 반응(initiation)은 탄소와 탄소의 이중 결합 중 결합의 homolytic bond breakage 또는 heterolytic bond breakage으로 인해 radical 및 ion initiator에 의해 중합을 거친다. reactive center가 지속적으로 전파되는 확산 반응(propagation)은 아래 그림과 같이 진행된다.
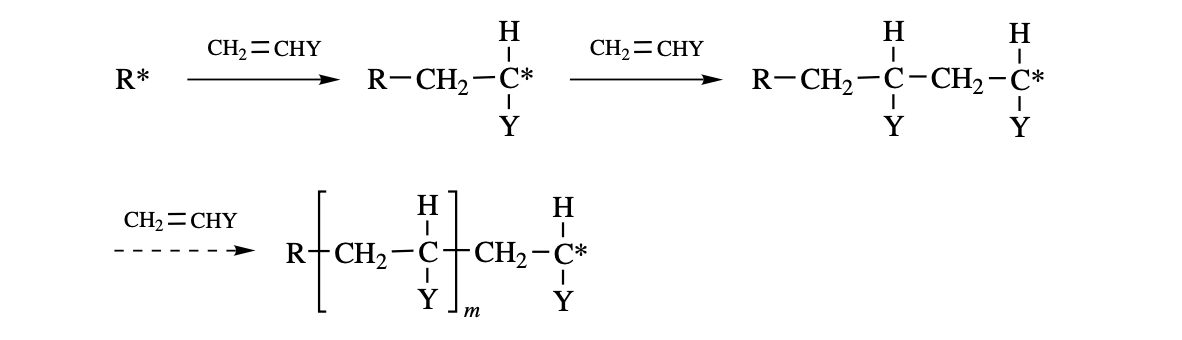
이때 polymer의 성장은 reactive center의 유형과 특정 반응 조건에 따라 적절한 반응에 의해 reactive center가 파괴딤으로 어느 시점에서 종료된다.
Comparison of Chain and Step Polymerization
chain 중합은 step 중합과는 매우 다른 메커니즘으로 진행된다. 가장 중요한 차이는 chain 중합에서는 높은 분자량의 polymer가 즉시 형성된다는 것이다. chain 중합에서 radical, anionic, cationic reactive center에 monomer가 달라붙으면서 chain이 성장하게 된다. 즉, polmyer의 성장은 오직 reactive center의 반응으로 일어난다. 이때 monomer의 농도는 높은 분자량의 polymer 수가 증가함에 따라 반응이 진행되는 전 과정에 걸쳐 감소한다. 또한 중합 반응의 어떤 시점에서도 반응 혼합물 속에서는 monoomer, 높은 부자량의 polymer 그리고 자라나는 chain만 존재한다. 그러므로 반응 시간에 따라 monomer에서 polymer의 퍼센트 전환률은 전체적으로 증가하지만 polmyer의 분자량은 반응 초기를 제외하고 큰 변화가 나타나지 않는다.
step 중합은 앞에서 여러번 다루었듯이, 어떠한 두 개의 분자가 자유롭게 반응할 수 있다. chain 중합에서는 monomer가 오직 성장 중인 chain의 끝의 active site와 반응하는 것과 다르다. 그렇기에 step 중합은 비교적 천천히 반응이 진행되면서 dimer, trimer, tetrame 등이 생성됨에 따라 monomer의 소진 속도가 증가한다. 이 결과로 분자량은 반응의 전 과정에 걸쳐 증가하며 높은 분자량의 polymer는 중합의 마짐가 단계에 이르기 전까지는 얻어지지 않는다. 즉, 높은 분자량의 polymer를 얻기 위해서는 높은 퍼센트 전환률, 긴 반응시간이 필요하다.
Radical Chain Polymerization
라디칼 체인 중합은 3가지 단계로 크게 나눌 수 있다. 각각 initiation, propagation, termination이다.
Initiation
initiation 단계는 2개의 반응을 포함한다. initiator로부터 free radical을 생산하는 단계이다. 이를 식으로 표현하면 아래와 같으며 이때의 속도상수는 가 된다.
이때 개시제에 의해 두 개의 free radical이 형성되는 것을 2개의 종류로 나눌 수 있다. 그 중 하나가 바로 homolytic scission, homolysis이다.
Homolysis
homolysis는 중성 분자가 2개의 free radical을 생성하면서 화학 결합이 끊어지는 것을 가리킨다. 이때 homolysis가 열에 의해서 일어나는지 혹은 UV에 의해서 일어나는지에 따라 thermolysis, photolysis로 나뉜다. 열에 의한 thermolyis는 약한 화학 결합을 가진 화합물이 50도 보다 높은 온도에서 열에 의해 homolysis가 일어나는 것을 의미한다. 대표적으로 peroixde나 azo linkage를 가진 화합물들이 thermolysis에 의해 2개의 free radical을 생성하는 개시제(initiator)로 사용된다. peroxide linkage를 가진 개시제는 BPO(benzoyl peroxide)와 -Butyl hydroperoxide가 있고, azo linakge를 가진 개시제는 AIBN(azobisisobutyronitrile)이 있다. UV 복사에 의한 photolysis는 homolysis가 열이 아닌 UV에 의해 일어나는 것이며, photolysis에 사용되는 개시제는 benzophenone과 benzoin alkyl ehter가 있다.
Redox reactions
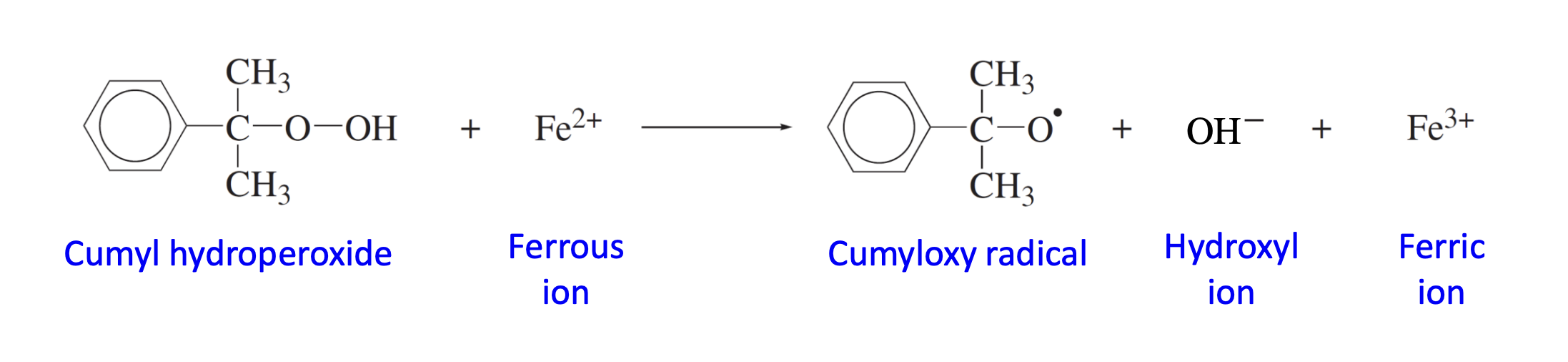
homolysis가 아닌 initiation으로 single-electron transfer process가 있다. 이온이나 분자로부터 하나의 전자가 이동하는 것을 의미한다. 대표적인 반응이 Redox reaction이다. 이는 낮은 온도(일반적으로 50도 이하)에서 라디칼 체인 중합이 필요할 때 사용된다. 대표적인 redox reaction은 아래와 같다.
이렇게 개시제가 free radicals를 생성하는 것에서 initiation이 끝나는 것이 아니다. initiation의 두번째 반응은 active center를 생성하기 위해 첫번째 monomer가 free radical과 반응하는 것이다.
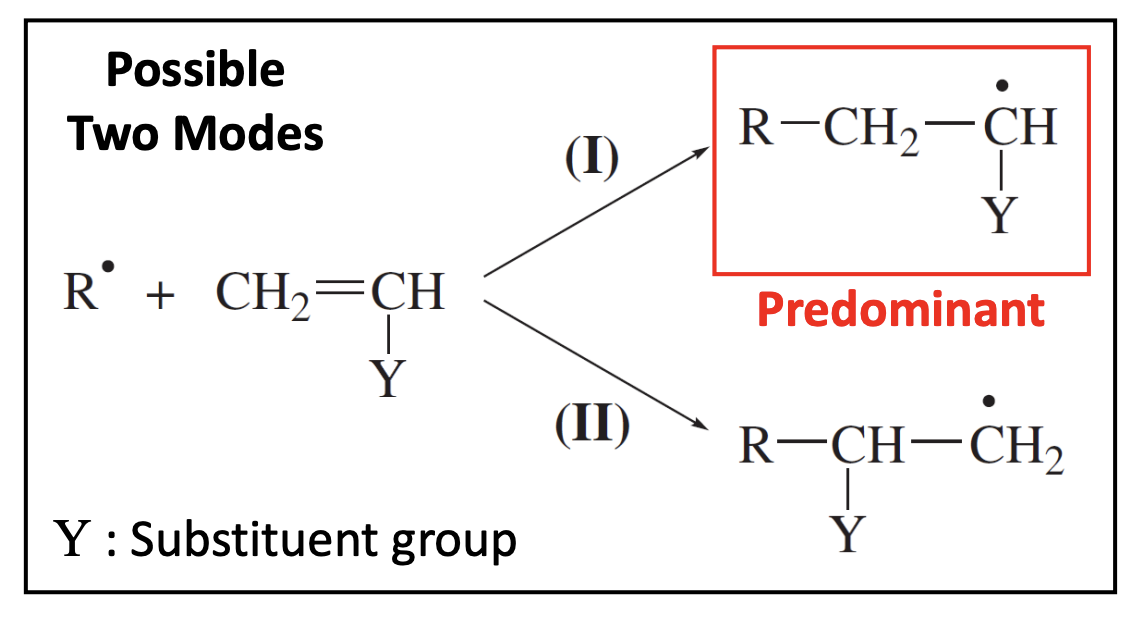
이때 이 반응의 속도 상수로 를 사용한다. vinyl monomer의 경우를 가정했을 때 아래와 같이 2개의 경우가 가능하지만, 주로 화학종 이 우세하다고 본다. 그 이유는 의 경우가 더 입체적으로 덜 방해받고, 공명 구조와 같이 substituent(치환체) group 에 의한 효과로 더 안정적이기 때문이다.
Propagation
propagation은 상당히 많은 수의 monomer 분자들이 성공적으로 추가됨으로 의 성장을 의미한다. monomer가 추가될 때마다 이전과 동일한 새로운 라디칼을 형성한다. 이러한 growing chain이 높은 분자량의 고분자로 전환되는 propagation은 매우 빠르게 일어난다. 이를 반응식으로 쓰면 다음과 같다.
이때 반응 속도 상수는 를 사용한다. 대부분 monomer에 대해 의 값은 이다. 아주 높은 값을 갖기에 몇 초만에 수천개의 monomer의 추가가 일어나게 된다. 그리고 이 값은 일반적인 step 중합의 속도 상수보다 훨씬 크다. propagation의 가능한 mode를 따져보면 initation의 개시 반응과 비슷하게 2개로 나눌 수 있다.
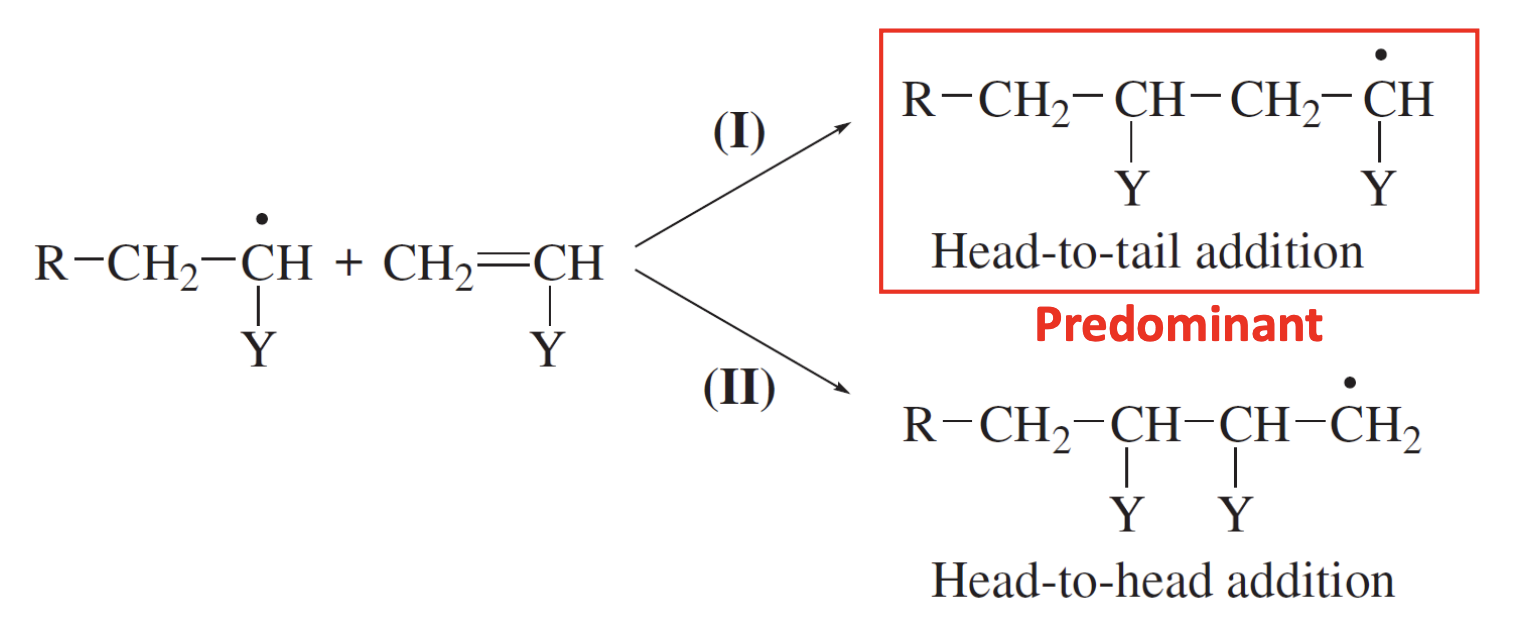
위 그림의 2개의 mode 중 가 더 우세하다. 그 이유는 구조를 가지면서 혹은 mode보다 더 안정하기 때문이다.
Termination
일정 지점에 다다르면, 고분자의 propagation 반ㅇ으은 멈추게 멈추게 되고 termination 반응이 일어난다. termination도 propagating chain의 bimolecular reaction에 의해 두가지 mode로 나눌 수 있다.
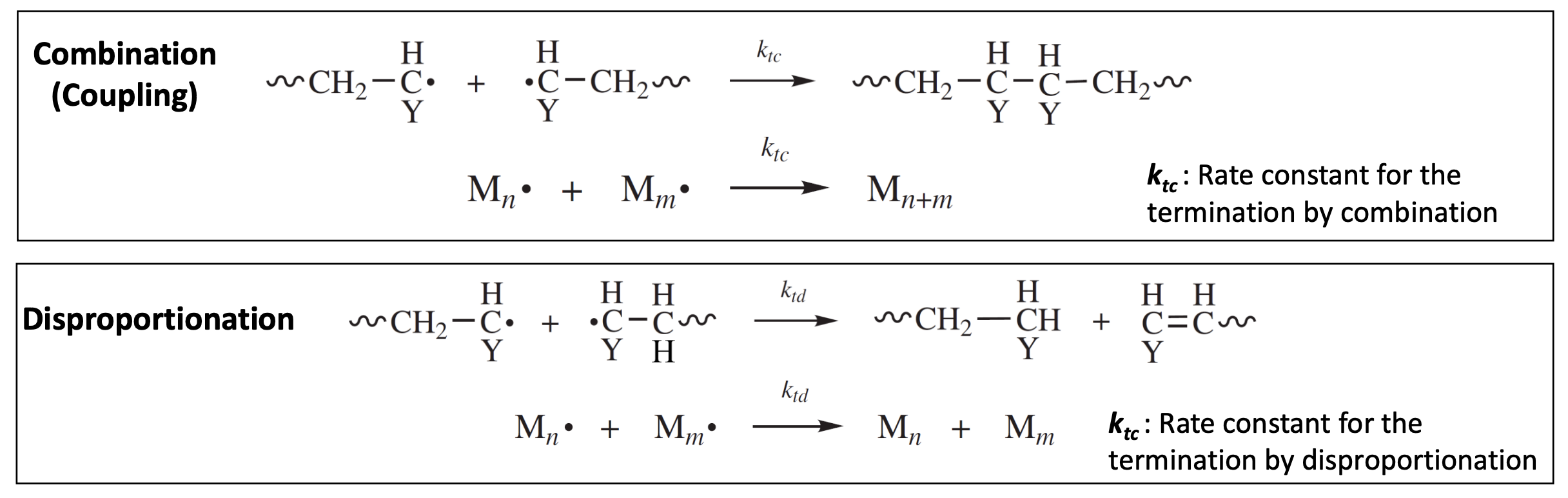
2개의 growing chain의 active center간의 반응으로 radical의 coupling 반응을 통해 termination이 일어나는 Combination과 radical의 disproportionation 반응을 통해 termination이 일어나는 Disproportionation이 있다. 각 termination 반응의 속도 상수는 를 사용하여 표현하며, 다음과 같은 간단한 표현도 가능하다.
위 반응의 속도 상수는 간략하게 를 사용하여 나타낸다.
