Types of Initiators
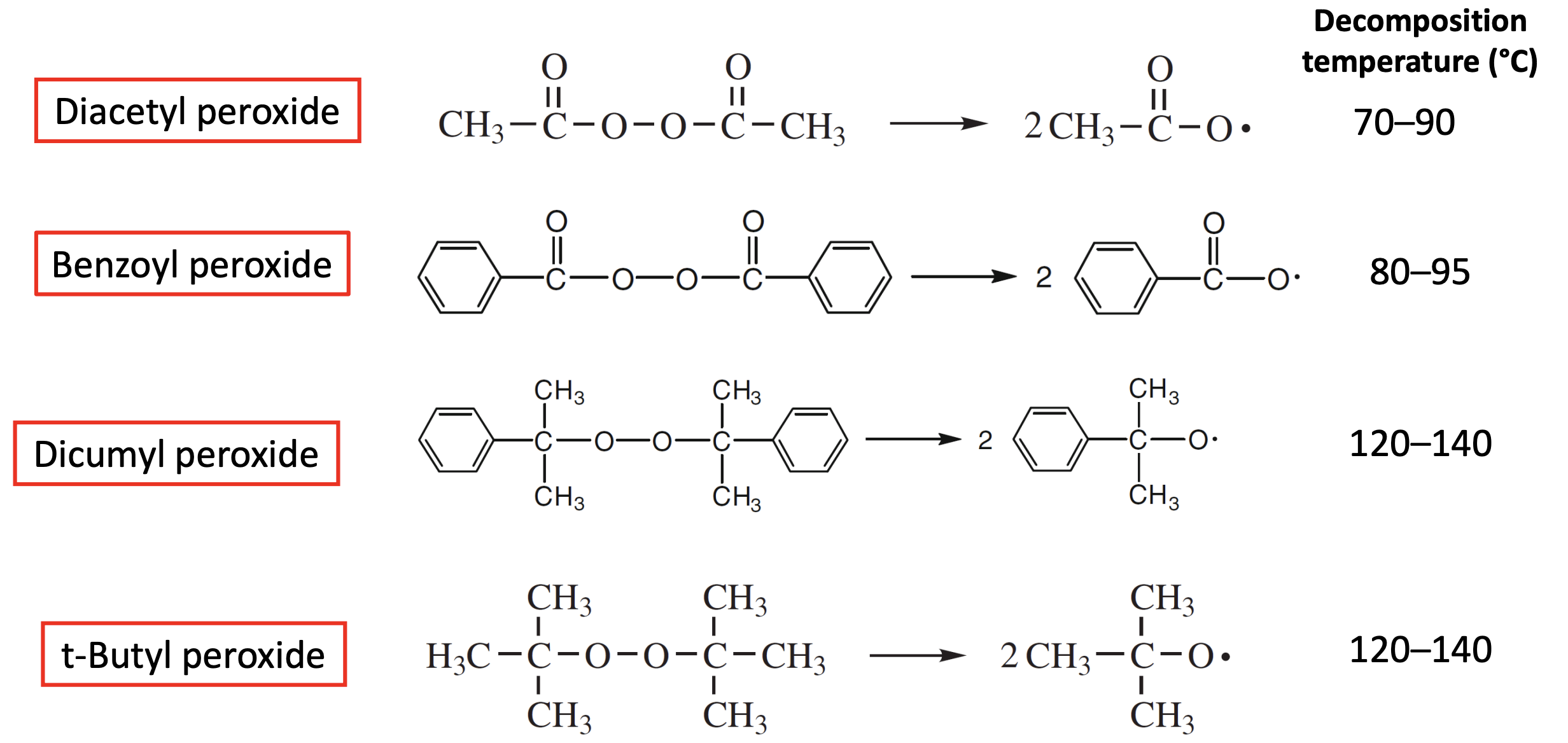
앞에서 라디칼 체인 중합 반응은 initiation, propagation, termination, 총 3단계로 나눌 수 있다고 하였다. 이때 initiation은 개시제가 어떤 조건에서 homolysis가 일어나냐에 따라 구분되는데, 라디칼 중합에 있어서 가장 널리 사용되는 것은 thermal homolysis, 즉, 개시제의 분해가 열에 의해 일어나는 것이다. 그럼 initiation의 첫번째 단계는 열에 의한 개시제의 분해 반응이고 두번째 단계는 active center를 생성하기 위한 free radical과 첫번째 monomer의 반응이 된다. 이때 thermal initiator의 조건은 범위의 bond dissociation energy를 가져야 한다. , , 와 같은 몇 개 되지 않는 종류의 화합물이 이 범위에 속한다. 그렇기에 peroxide가 가장 널리 사용되는 radical source가 된다. 대표적인 thermolysis dissociation을 일으키는 radical initiator들은 다음과 같다.
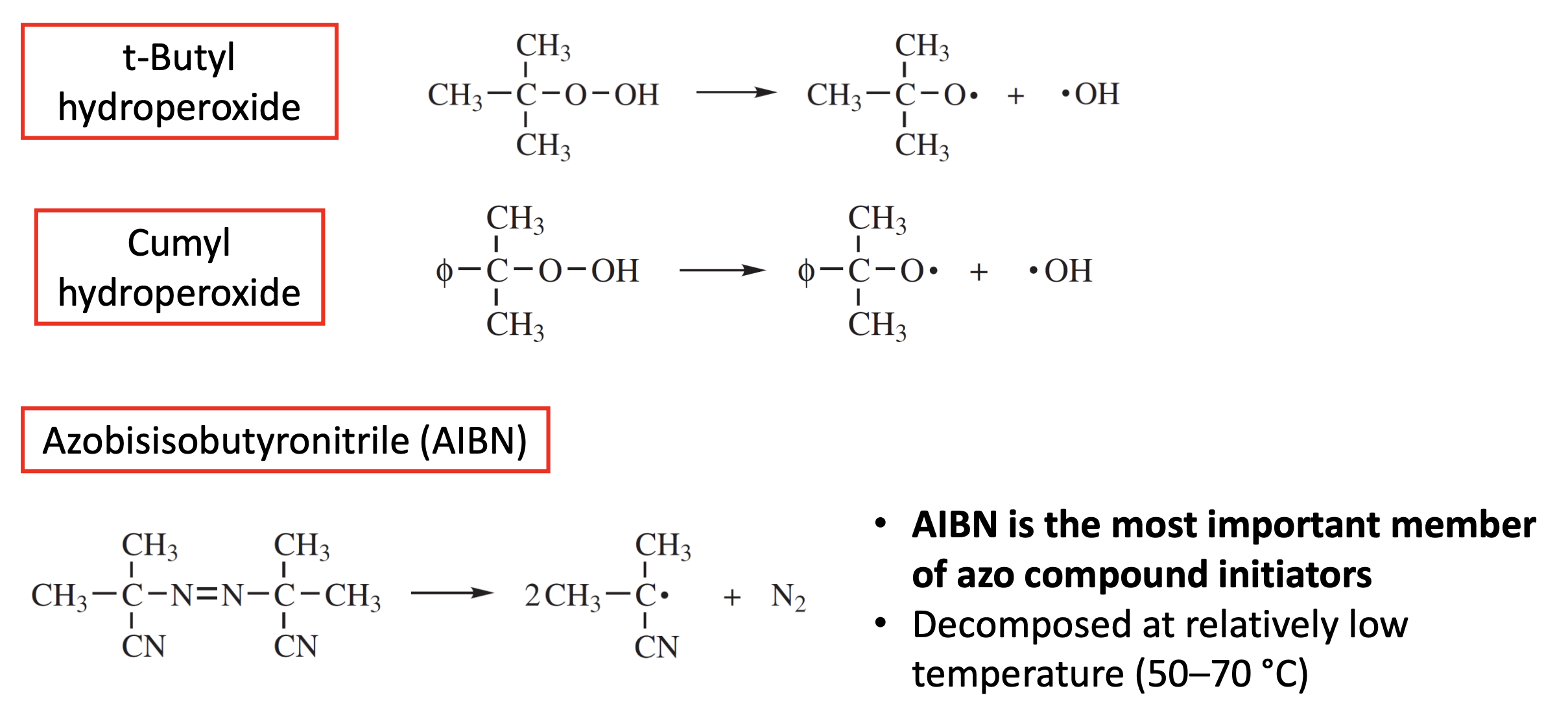
AIBN
이때 AIBN은 가장 중요한 azo 화합물 개시제인데, 이 화합물이 중요한 이유는 다음과 같다.
- 50~70도의 상대적으로 낮은 온도에서 분해된다. 이는 열적으로 민감한 monomer나 matrics에서 더 안정적인 환경을 제공하면서 중합 반응이 일어나게 한다.
- 효과적으로 라디칼을 생성해준다. AIBN은 분해를 겪으면서 2개의 radical을 포함한 cyanide를 생성하게 된다. 그리고 이때 질소 가스()를 함께 생성하는데, 이는 매우 높은 효율의 initiation 반응을 일으킨다.
- 다용도 응용이 가능하다. AIBN은 다양한 종류의 고분자를 만드는데 사용된다.
- AIBN은 고체 power의 형태로 존재할 수 있기 때문에 상대적으로 다루기 쉽고 저장/운반에도 용이하다. 다만 낮은 온도에서 분해된다고 아까 언급했듯이, 빛이 통과하지 않는 용기에서 냉장 보관해야하는 유의점이 있다.
Initiation Kinetics
initiation은 결국 두 단계로 나뉘는데 첫번째 단계가 개시제가 free radical을 생성하는 것이고, 두번째 단계는 active center를 생성하기 위해 radical과 monomer의 반응이다. 이를 각각 식으로 나타내면,
이다. 여기서 첫번째 단계의 속도 상수를 , 두번째 단계의 속도 상수를 라고 하자. 이때 첫번째 단계의 반응 속도가 훨씬 느리기에 의 반응이 RDS(Rate Determinant Step), 속도 결정 단계가 된다. 그럼 initiation 반응의 속도를 다음과 같이 식으로 나타낼 수 있다.
여기서 는 initiator efficiency(개시제 효율)이다. 부반응 때문에 형성된 모든 라디칼이 monomer를 공격하지 않기 때문에 이를 고려해주어야 한다. 즉, 를 통해 실질적으로 개시제의 라디칼로 인해(primary radical) propagation까지 진행되는 radical의 비율을 고려할 수 있게 된다. 그리고 는 앞에서 설명했듯이, RDS인 initiator의 분해(dissociation)의 속도 상수가 되고, 대부분의 개시제에 대해 값은 의 값을 갖게 된다. 는 개시제의 농도이다. 물론 이 양은 monomer에 비해 상대적으로 0.01~1%의 양으로 매우 적을 것이다.
또한 개시제의 반감기를 계산할 수도 있는데, 이때는 의 식을 사용한다.
반감기는 일 때를 의미하므로, 대입해주면
이렇게 구한 반감기를 개시제에 따라 표로 나타내면 다음과 같다.
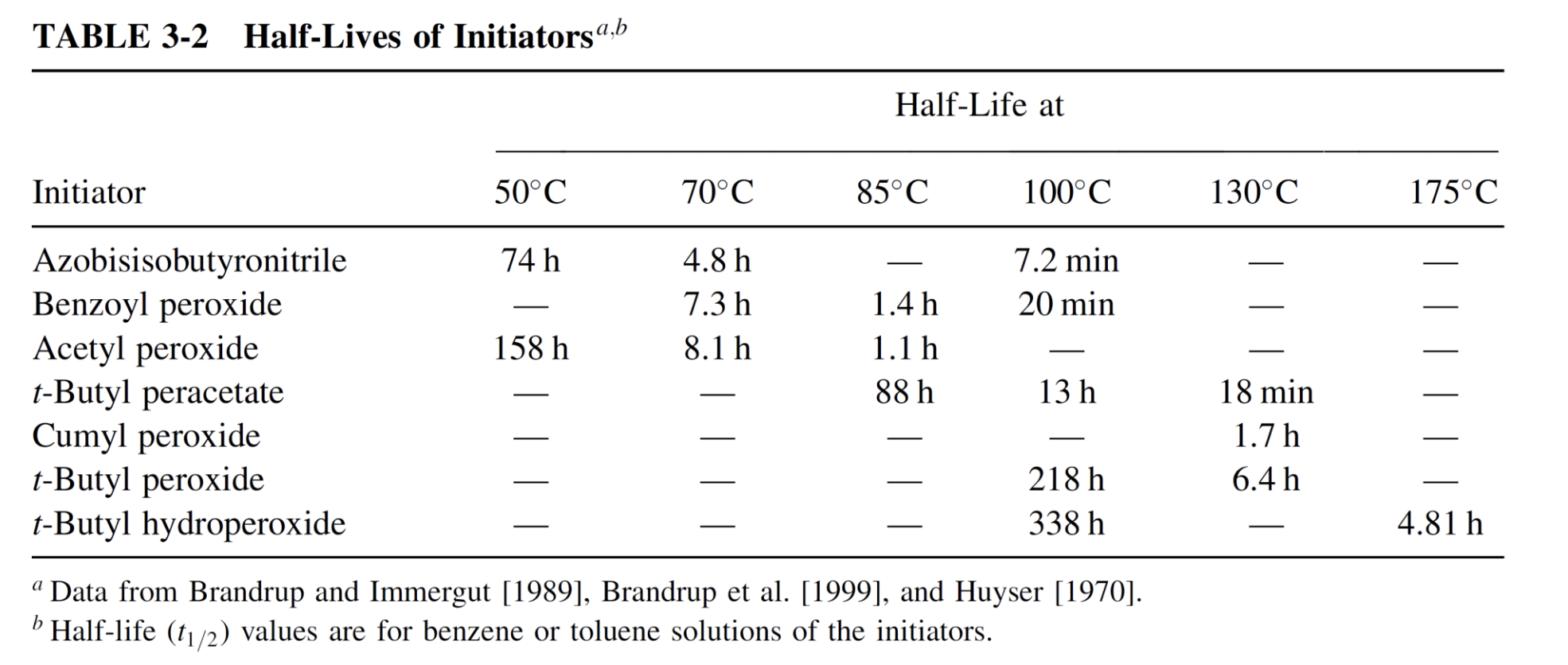
온도 증가에 따라 반감기가 감소하는 것을 확인할 수 있다. AIBN, BPO, acetyl peroxide는 상대적으로 낮은 온도에서 분해되기에 대부분 조기 분해 및 중합을 방지하기 위해 보통 중합 직접에 monomer에 첨가한다.
Redox Initiation
위의 경우에는 thermal homolysis에 의해 1차 라디칼이 생성되는 것을 속도론 관점에서 알아본 것이다. 그런데 initiation의 종류에는 열에 의한 thermolysis뿐만 아니라 UV에 의한 photolysis도 존재하고 이온이나 분자에서 전자 하나가 이동함으로 initiation이 일어나는 redox reaction도 존재한다. redox initiation은 산화 환원 반응처럼 단일 전자가 이온 또는 분자로 이동하면서 개시 반응이 일어나는 것으롤 저온에서 라디칼 중합을 사용할 때 주로 사용된느 방법이다. 많은 산화 환원 반응은 중합 반응을 개시하는데 사용할 수 있는 라디칼을 생성하고, 라디칼의 생성이 특정 산화 환원 계에 따라서는 0~50도의 온도 및 더 낮은 온도에서조차 개시할 수 있는 매우 넓은 온도 범위에 걸쳐 적절한 속도로 일어난다.
Redox Initiator
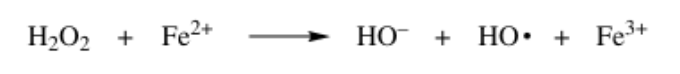
위 반응을 Fenton reaction이라 부른다. 산화철 2가 이온은 과산화물의 산소에 전자를 주어 인접한 산소-산소 과산하물 결합을 균질하게(homolytically) 끊는다. 이에 따라 산소 원자는 두번째 전자를 받아 음전하를 띄는 hydroxyl ion이 되고 과산화물 결합에서 남은 산소 원자는 다른 과산화물 결합 전자를 받아 과산화물 결합을 끊어나간다. 이러한 redox reaction의 개시제로 cumyl hydroperoxide가 있다. 반응 과정은 다음과 같다.
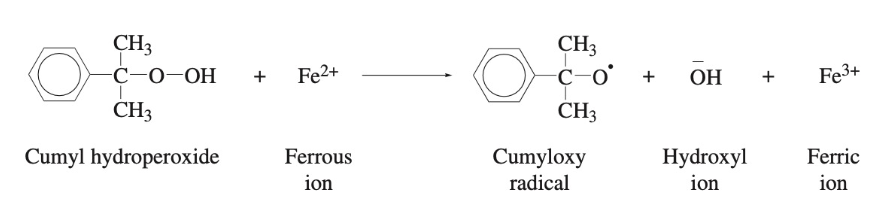
대부분의 산화 환원 계는 수용액 또는 유화계(emulsion system)이다.
Rate of Redox Polymerization
redox reaction으로 개시제를 라디칼로 분해하여 radical chain 중합을 일으키는 redox polymerization의 속도를 알아보자. 우선 개시 반응의 속도는 다음과 같이 쓸 수 있다.
SSA에 의하면 이고 이라 쓰면 은 다음과 같이 나타내진다.
이므로 대입해주면, redox polymerization의 속도는 다음과 같다.
Photochemical Initiation
photolysis에 의한 개시 반응을 Photochemical Initiation이라 부른다. 광화학적 또는 광개시 중합은 반응계에 자외선 또는 가시광선을 쪼여줌으로 라디칼이 형성되는 경우 일어난다. 일반적으로 빛의 흡수는 다음의 두 가지 중 하나의 경로에 의하여 라디칼을 생성한다.
첫번째로 계에 존재하는 몇몇 화학물은 에너지를 흡수하여 excitation이 일어난 뒤 라디칼로 분해된다.
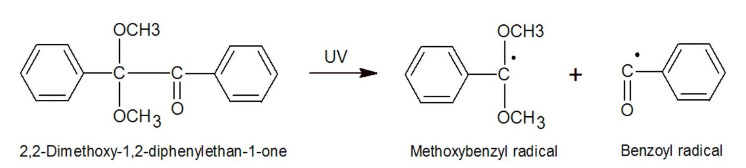
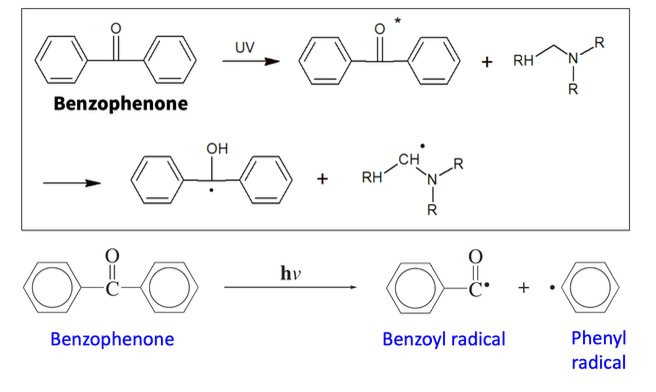
혹은 어떤 화학물은 excitation 이후 들뜬 상태에서 제 2의 화합물과 상호작용(energy transfer 또는 redox reaction)을 일으켜 라디칼을 형성하게 된다.
Advantange / Limitation of Photopolymerization
photochemical 개시반응은 우선 라디칼의 생성과 중합 반응을 위치에 따라 조절할 수 있다. 즉, 광원을 껐다 켰다 하는 것으로 라디칼의 생성과 중합을 진행시키거나 멈출 수 있다. 그렇기에 특정 영역에 국한시켜 중합 반응을 진행시키는 것도 가능하다. 또한 개시 속도가 매우 빠르고 라디칼 source(개시제)의 종류, 빛의 강도, 온도를 조절함으로 개시 속도를 조절할 수도 있다. 상업용 광중합은 일반적으로 무용제(solvent-free) 시스템에서 사용되고 경제적, 환경적 고려 사항에서 이점을 제공한다. 다만 재료의 두께에 의해 빛 에너지의 낮은 투과율이 광중합의 한계점이 된다. 이런 특성으로 광중합은 금속, 종이, 목제 및 플라스틱용 바니시(varnish)나 인쇄 잉크 및 코팅의 초고속 건조, 집적 및 인쇄회로와 같은 표면/박막 응용 분야에 적합하다.
Initiator Efficiency
이제 개시제 효율성에 대해 좀 더 자세히 알아보자. 는 부반응, wastage reaction에 의해 1보다 낮은 값을 갖게 되고 보통 0.3~0.8 사이의 값을 갖는다. 아래의 BPO의 예시를 보자.
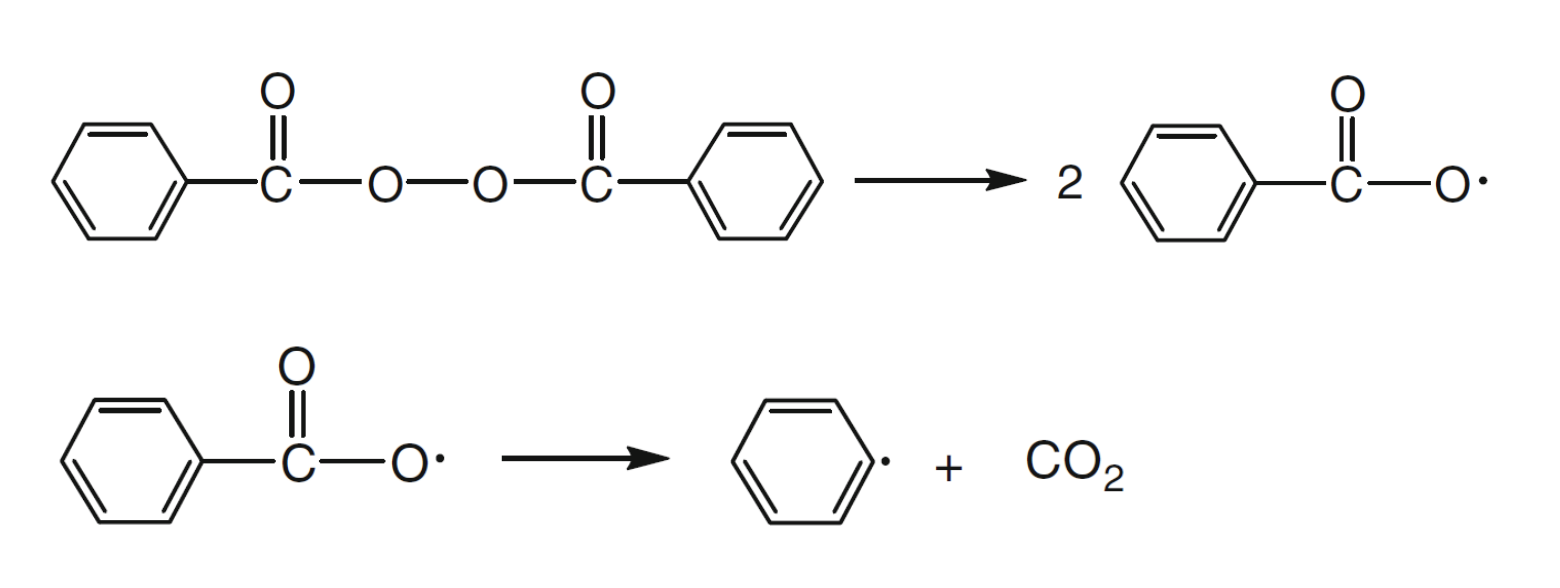
thermolysis에 의해 benzoyloxy radical등이 생성된다. 위에서 이야기한 부반응은 이렇게 형성된 benzoyloxy radical이 monomer와 반응하는 것 외에 여러 반응이 일어나는 것을 의미한다.
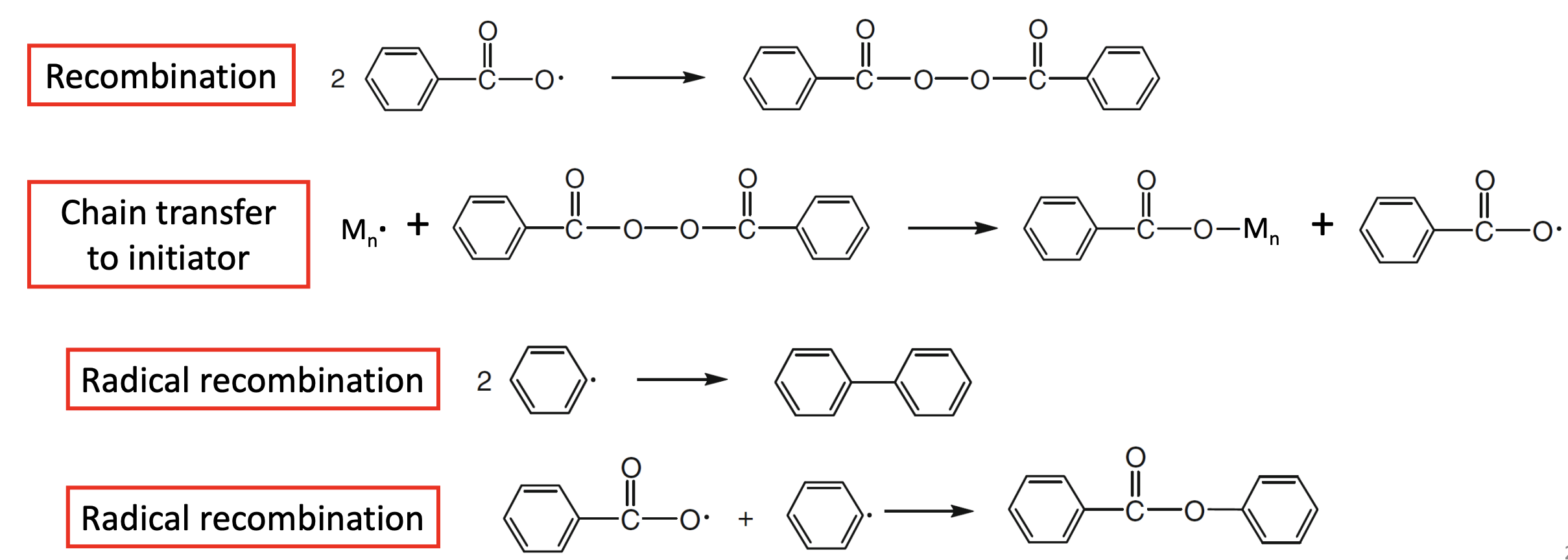
대표적으로 위 그림과 같은 4개의 경우가 있을 수 있다.
Cage Effect
initiator efficiency 인 메커니즘은 cage effect로 설명이 된다.
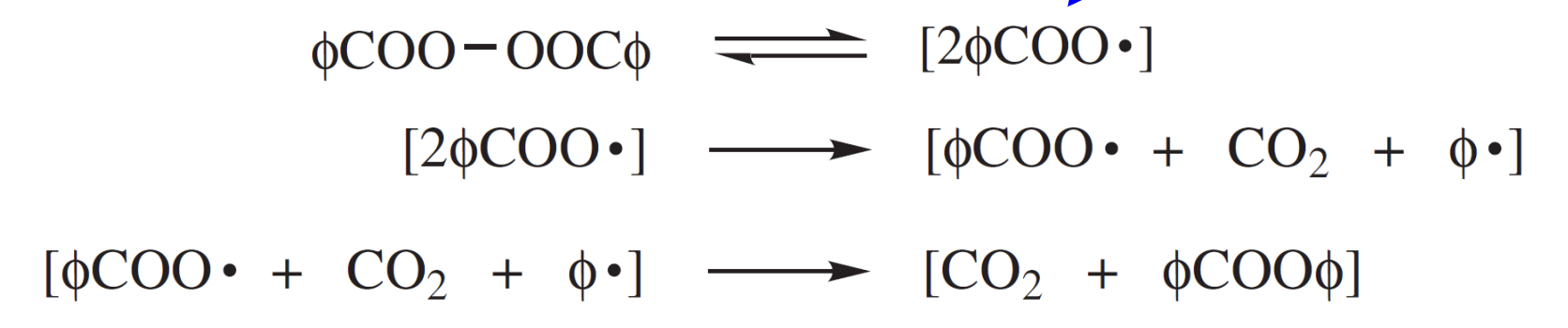
위와 같이 개시제의 분해 이후 생성되는 라디칼은 solvent cage에 갇히게 된다. solvent cage는 위 식에서 으로 표현하며 라디칼이 퍼지기 전에 짧은 시간 동안 라디칼이 sovlent 분자에 의해 둘러 싸이는 것을 표현한 것이다. 즉, solvent cage는 반응 중 형성된 라디칼들이 일시적으로 solvent 분자에 의해 trap되는 현상을 말한다. trap은 물리적 장벽을 이야기하는 것이 아니라 라디칼 주변의 solvent 분자들의 local concentration에 의한 효과를 의미한다. 이때 라디칼들의 운동, 반응성에 따라 cage effect는 달라진다. solvent cage안에서 라디칼들은 짧은 시간 동안 서로 밀접하게 유지된다. 이는 라디칼이 확산되어 추가적인 연쇄 propagation을 일으키지 못하고 서로 상호작용하여 라디칼의 재결합이나 라디칼의 이동이 일어날 확률을 높인다. cage effect의 탈출 메커니즘은 라디칼 주변의 solvent 분자들이 재배열되어 라디칼이 확산할 수 있는 경로를 허용하게 되면서 일어나는 것이다. 이때 탈출을 하냐 라디칼의 재결합이 일어나냐의 확률은 용매의 점도와 온도에 의해 결ㅈ렁된다. 용매의 점도가 높을수록 라디칼의 이동을 방해하여 cage내에서 상호작용할 확률을 높이고, 온도가 높을수록 운동 에너지가 증가하여 cage 밖으로 확산되는 속도를 높일 확률이 높다. 이외에도 라디칼의 농도가 높을수록 더 잘 탈출할 수 있다.
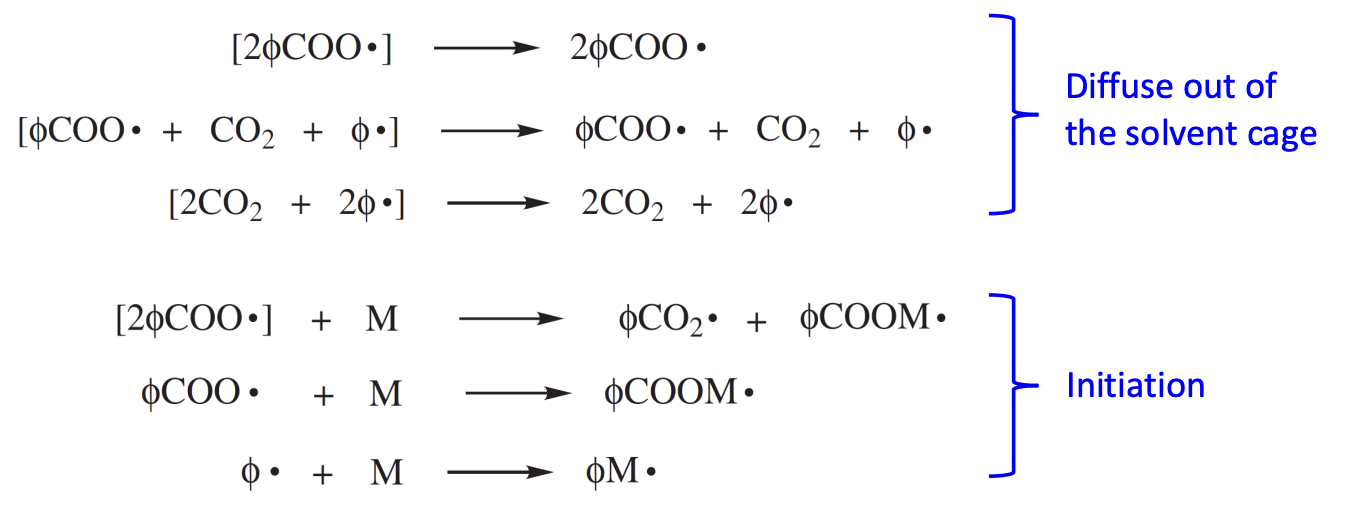
위와 같은 반응처럼 라디칼이 solvent cage 밖을 탈출하여 확산하면 monomer와의 반응이 우선적으로 발생한다.
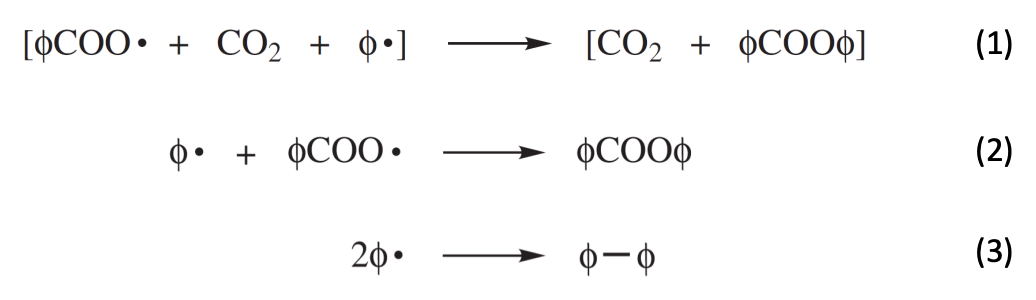
다만 위 경우와 같은 반응에 의해 값은 감소하게 된다. 특히 식 (1)의 반응이 cage effect에 의해 의 감소에 가장 큰 영향을 미칠 것이다.
Acetyl Peroxide
cage effect를 예시를 통해 알아보자. acetyl peroxide로부터 형성된 acetoxy radical들은 solvent cage 내부에서 partial decarboxylation과 radical combination이 일어난다. 다음과 같은 식을 따르게 된다.
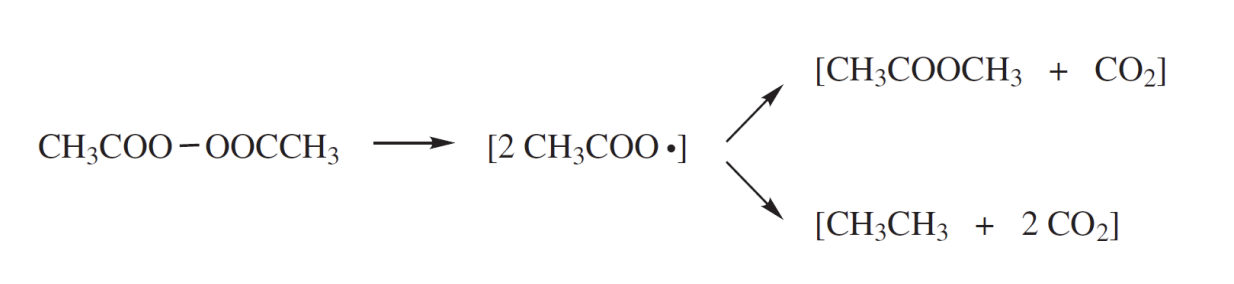
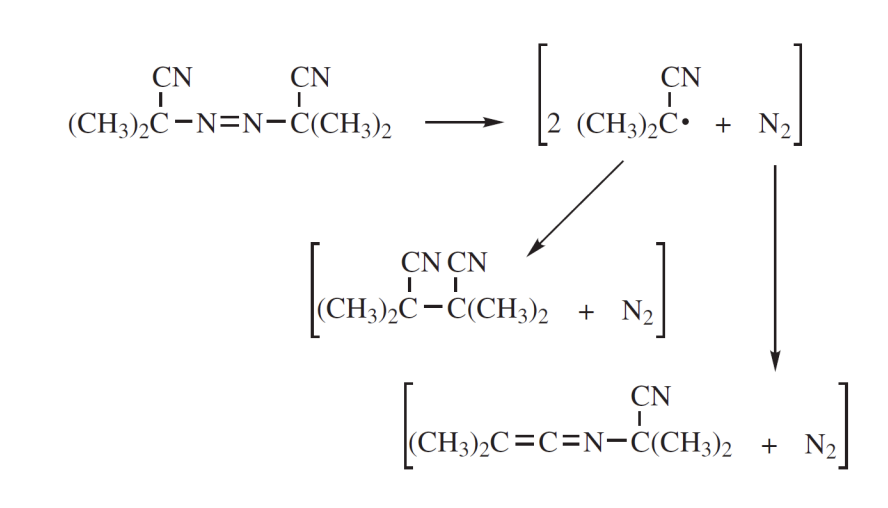
AIBN
AIBN의 homolysis는 결합이 끊어지면서 와 2개의 라디칼을 생성한다. solvent cage 내에서 라디칼끼리 반응하게 되면 tetramethylsuccinonitrile 또는 dimethyl-N-(2-cyano-2-isopropyl)ketenimine을 생성하게 된다.