Kinetic Chain Length
kinetic chain length는 로 표시하며 고분자의 molecular weight와 관련있는 값이다. 이 값은 고분자 사슬의 생성을 개시하는 라디칼 한 개가 평균적으로 소비하는(중합하는) monomer 분자의 개수로 정의된다. 그러므로 중합 반응 중 propagation의 속도를 initiation의 속도로 나누어주면 값을 얻을 수 있을 것이다. 여기서 SSA에 의해 initiation 반응 속도와 termination 반응 속도가 동일하다고 했으므로, 은 상수 값이 되고 를 다음과 같이 정의할 수 있다.
앞에서 구했던 와 를 대입해주면, 최종적으로 는 다음과 같다.
위 식으로 알 수 있는 것은 kinetic chain length는 개시제의 농도나 개시제 효율(initiator efficiency)값이 증가함에 따라 감소한다는 것이다. 그 이유는 개시제의 농도나 개시제 효율이 증가하면 성장하는 chain의 수가 증가하기 때문에 그만큼 kinetic chain length의 값은 감소하게 될 것이다. 즉, 개시제나 monomer의 농도를 바꾸어줌에 따라 고분자의 molecular weight를 조절할 수 있다는 뜻이다.
Mode of Termination
우선 수평균 중합도 은 고분자에 포함된 monomer 분자의 평균 수로 정의되는 값이다. 그렇기에 위에서 정의한 kinetic chain length 값과 연관이 있을 것이다. 그런데 라디칼 체인 중합 중 termination step에서는 2개의 단계가 존재한다. chain radical species가 서로 만날 때 하나의 chain으로 합쳐지는 combination(coupling)과 하나는 말단의 수소와 반응하고 다른 하나는 불균등하게 수소를 잃으면서 이중 결합이 형성되는 disproportionation이 있다. 이를 고려했을 때 는 어떻게 정의될까? 아래의 그림을 보면 combination에서는 로 disproportionation에서는 로 정의될 수 있다는 것을 알 수 있다.
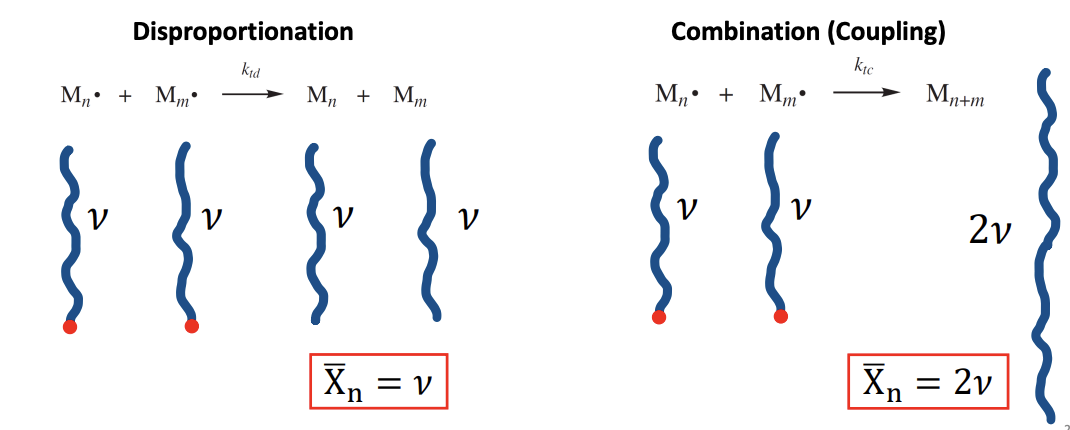
위와 같이 과 의 관계가 정의도는 이유를 알아보자. 우선 수평균 중합도 의 정의에 따라 다음과 같이 쓸 수 있다.
여기서 2개의 termination mode를 모두 고려하면 다음과 같이 쓸 수 있다.
이때 는 다음과 같이 정의되므로,
에 대해 정리하면,
이다. 이 값을 에 대한 식에 다시 대입해주면,
라는 식을 얻을 수 있다. 여기서 만약 combination이 우세한 termination step이였다면, 이므로 이다. 이를 그대로 위 식에 대입해주면,
가 되고, 만약 disproportionation이 우세한 반응이였다면, 이므로 이다. 이를 그대로 위 식에 대입해주면,
실험적 경험과 데이터에 의해 대부분 고분자의 termination은 coupling에 의해 이루어진다고 알려져있다. disproportionation의 발생 빈도는 reaction system에 따라 다른데, propagating 라디칼이 입체 방해를 받을 때 그 빈도가 증가한다. 예를 들면 -수소가 많은 경우가 그 예시가 된다. 그런데 styrene과 methyl acrylate, acrylonitrile의 경우에는 coupling에 의해 termination이 일어난다. methyl methacrylate는 coupling과 disproportionation 모두 일어나면서 termination이 진행된다. 이런 monomer의 종류 외에도 온도를 증가함에 따라 disproportionation의 빈도가 증가한다고도 알려져있다. 이 온도에 의한 증가도 입체 방해를 받는 라디칼일수록 더 크게 나타난다고 알려져있다.
