Determination of
값을 결정하는 것은 Mayo equation에서 특수한 경우를 가정하는 것이다. 중합 조건을 적절히 선택하면 여러 monomer나 개시제의 값을 결정할 수 있는데, 이는 개시제를 매우 낮은 농도로 사용하거나 AIBN과 같은 개시제처럼 값이 무시할만큼 작다면, Mayo equation의 term만 사용할 수 있게 된다. 그리고 중합 반응의 전 과정에서 개시제의 농도를 적절히 유지하여 의 값도 일정하게 유지한다면, Mayo euqation은 다음과 같이 쓸 수 있다.
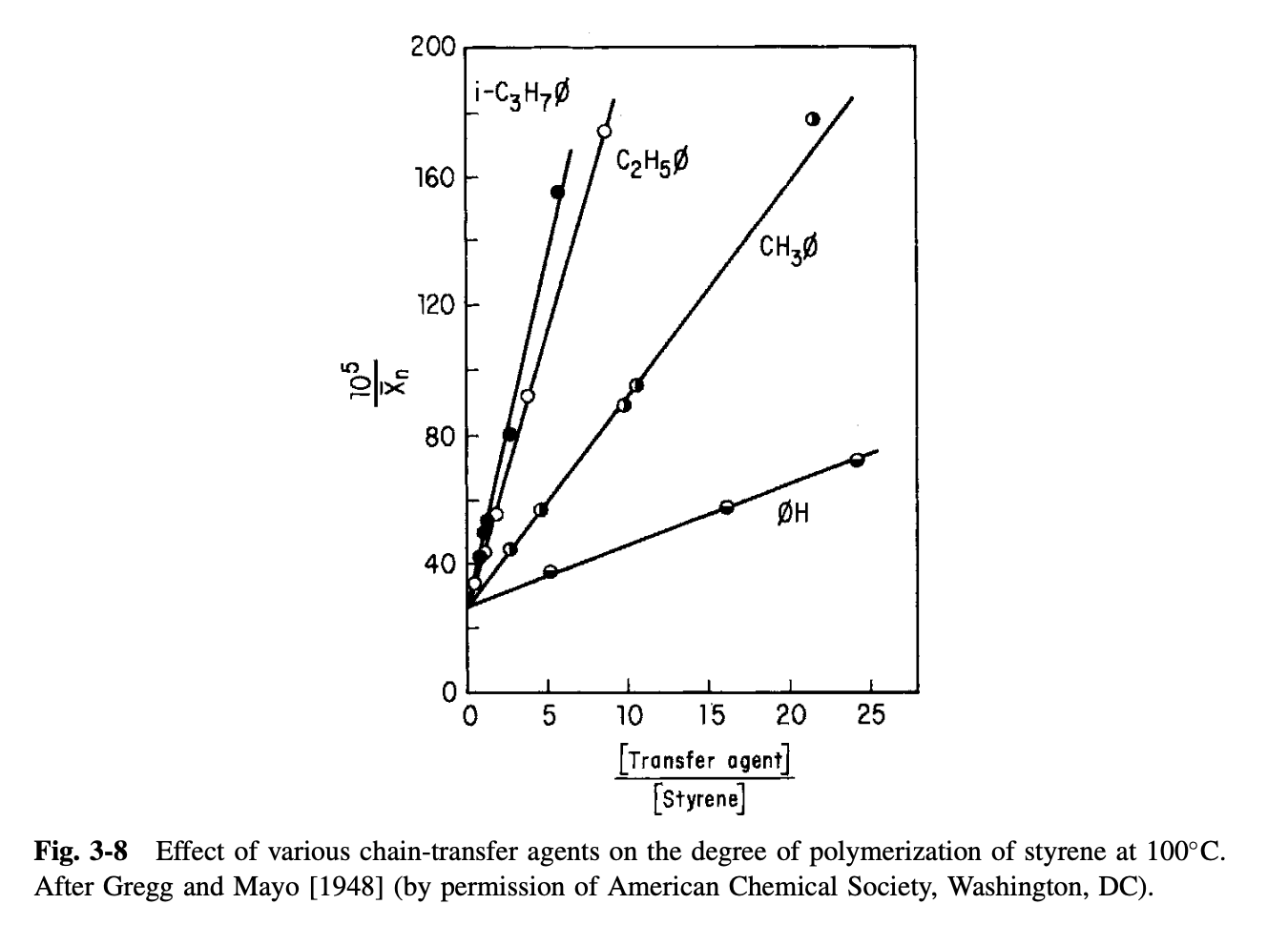
즉, chain transfer agent에 의한 영향이 가장 지배적인 상황을 가정하는 것이다. 위 식에서 을 로 좌변을 로 두고 plot하면 아래와 같은 그래프가 되고, 절편은 가 되고 기울기는 가 될 것이다.
Structure and Reactivity
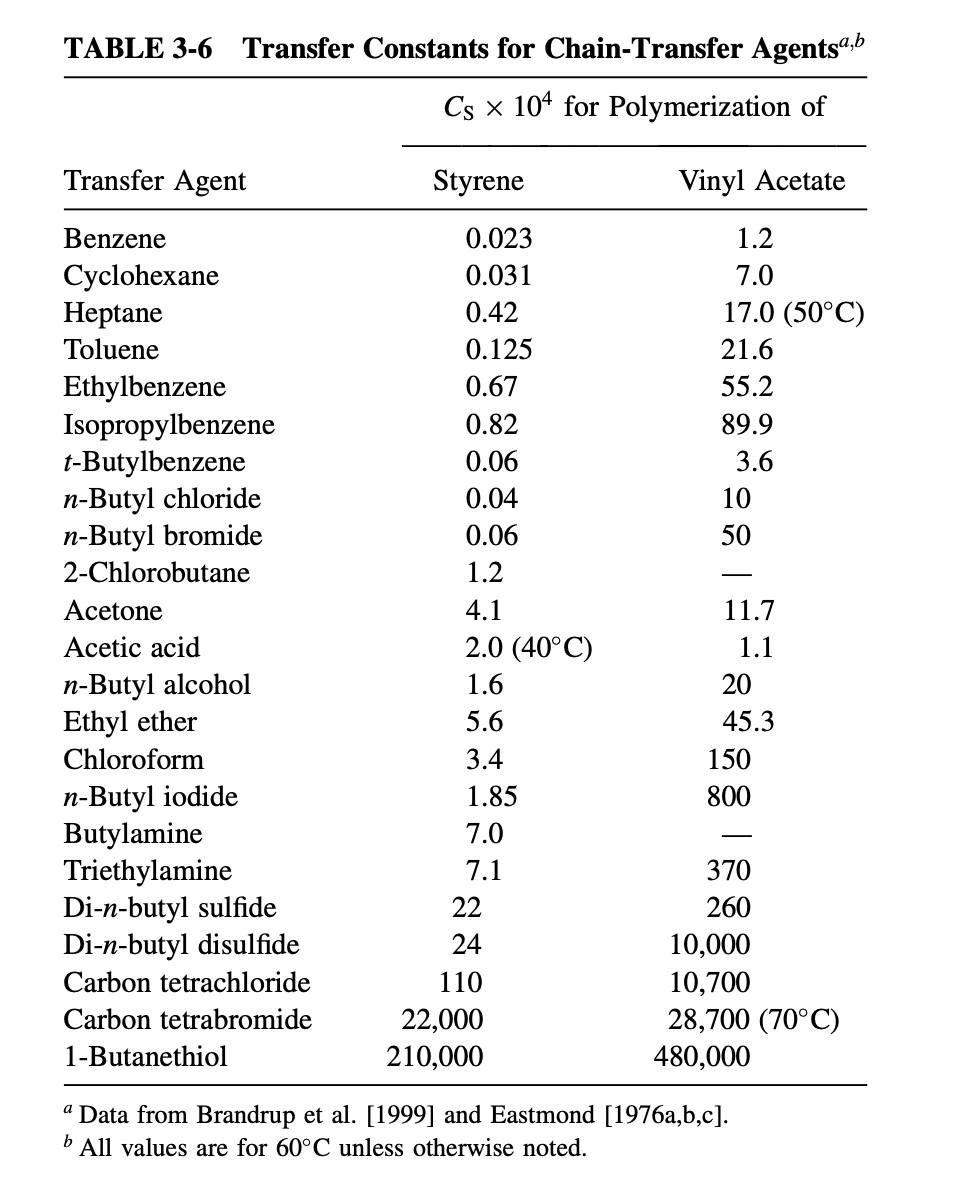
우선 위 표를 보면 cyclohexane과 같이 강한 탄소-수소 결합을 가진 지방족 탄화수소의 의 값이 작다는 것을 알 수 있다. benzene의 경우에는 이보다 더 강한 탄소-수소 결합을 가지기에 더 작은 값을 갖는다. benzene으로 라디칼이 전달되는 chain transfer는 benzylic hydrogen이 빼앗기면서 일어나는 것이 아니라 성장 라디칼이 benzene에 첨가되어 일어나는 것으로 보인다.
또한 benzene, toluene, ethylbenzene, isopropylbenzne의 순서로 값이 증가하는 이유는 benzylic hydrogen을 더 쉽게 떼어낼 수 있으면 chain transfer가 더 잘 일어나기 때문이다. 순서대로 benzylic hydrogen은 0개, 3개, 5개, 7개이므로 isopropylbenzene의 benzylic hydrogen이 benzene이나 toluene보다 상대적으로 더 쉽게 빼앗긴다. toluene의 경우 benzylic hydrogen이 빼앗기면 결과적으로 생성되는 라디칼 화학종은 아래와 같은 resonance structure를 통해 안정화될 수 있기에 benzene보다 더 작은 값을 갖게 된다.

그리고 높은 값을 갖는 transfer agent들을 살펴보자. 우선 disuflide의 경우에는 황-황 결합이 매우 약하기에 쉽게 chain transfer가 일어난다. 즉, 값이 커진다는 것이다.
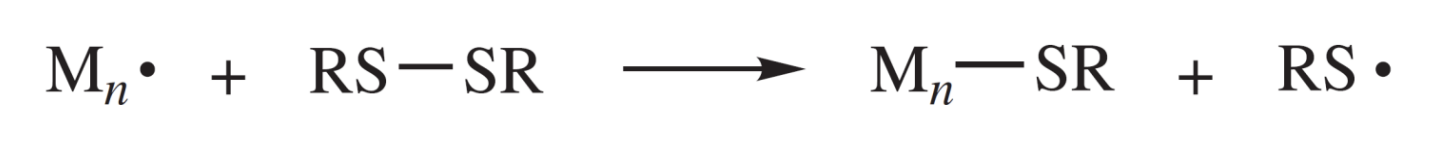
thiol의 경우에는 가장 큰 값을 갖는데 그 이유는 황-수소 결합은 매우 약한 결합으로 알려져 있기 때문이다. 그리고 tetrachloride와 carbon tetrabromide의 경우에는 탄소-수소 결합이 할로겐 자유 전자 쌍을 포함하는 공명에 의해 형성된 trihalocarbon 라디칼의 탁월한 안정화 때문에 특히 약하기 때문에 값이 크다.

위 표를 보면 같은 transfer agent의 값은 어떤 monomer 중합에 사용하는 지에 따라서도 달라진다는 것을 알 수 있다. 그 이유는 무엇일까? vinyl acetate의 propagating radical이 styrene의 propagating radical보다 반응성이 높기 때문이다. 즉, transfer agent의 값은 propagating radical의 반응성이 높을수록 높은 값을 가지며 그 순서는 다음과 같다.
Practical Utility of Mayo Equation
chain transfer agent를 첨가하는 것이 initiator나 monomer에 의한 효과를 고려하는 것보다 molecular weight를 낮추는 가장 간단한 방법이다. 이때 chain transfer agent를 regulator 또는 modifier라고 부르기도 한다. 값이 큰 transfer agent를 사용하는 경우는 보통 낮은 농도로 투입하기 위해 사용한다. 낮은 농도로도 큰 효과를 볼 수 있고, 더 많은 농도의 transfer agent를 사용함에 따라 가격이나 물성이 변화되는 여러 이유가 존재하기 때문이다. 대표적인 예시가 이다. styrene과 1,3-butadiene을 SBR로 만들기 위한 에멀젼 공중합(emulsion copolymerization)에서 주로 사용된다.
