3-13b Solution Polymerization
용매에서 monomer 의 중합은 bulk process 의 많은 단점을 극복한다. 용매는 중합 과정의 열 전달에서 diluent 와 aids 로 동작한다. 또한 용매는 혼합물의 점도를 감소시키기 때문에 쉽게 교반되게 한다. solution polymerization 에서 열적 제어(thermal control)는 bulk polymerization 에 비해 훨씬 쉽다. 반면에 용매의 존재는 새로운 어려움을 제공하기도 한다. 충분한 고려 없이 용매를 고르지 않았다면, 용매로 chain transfer 반응이 일어나 문제가 될 것이다. 더 나아가 고분자의 순도도 용매의 제거가 쉽지 않다면 영향을 받게 된다. Vinyl acetate, acrylonitrile 그리고 esters of acrylic acid 는 용액에서 중합된다.
3-13c Heterogeneous Polymerization
불균일계 중합(heterogeneous polymerization)은 광범위하게 열적 또는 점도 문제를 해결하기 위해 사용된다. 3가지 종류의 불균일계 중합이 존재한다. precipitation, suspension 그리고 emulsion 이다. Precipitation 중합은 균일계 중합으로 시작하지만 순식간에 불균일계 중합으로 바뀐다. 이는 monomer 가 반응 중간체(reaction medium) 안에서 형성된 고분자가 불용성(insoluble) 인 bulk 또는 용액 안에서 중합될 때 일어나는 현상이다. Precipitation 중합은 최종적으로 얻어지는 고분자의 형태로 인해 종종 poweder 또는 granular 중합으로 부르기도 한다. Precipitation 중합에 사용되는 개시제(initiator)는 최초 반응 중간체에 잘 녹는다.(soluble). 중합은 침전 후 고분자 입자들 안으로 monomer 와 개시제를 흡수시켜 진행된다.
Suspension 중합(또는 bead, pearl 중합으로 불리는)은 불연속 상(discontinuous phase)인 monomer 가 연속상(continuous phase)인 물에서 방울(droplet)으로 현탁되는 과정에 의해 이루어진다. Styrene, acrylic 그리고 methacrylic esters 등 여러 고분자가 suspension 방법에 의해 중합된다. 물과 monomer 의 비율은 부터 까지 다양하다. monomer droplet 은 agitation 또는 suspension stabilizer(dispersants 또는 surfactants 라고도 함) 에 의해 붕괴되지 않는다. 2가지 종류의 stabilizer 가 사용되는데, 하나는 수용성 고분자(water-soluble polymer)이고 다른 하나는 물에 불용성인 무기 화합물(water-insoluble inoragnic compound)이다.
suspension stabilizer 는 일반적으로 수용성 고분자가 더 높은 농도로 사용되지만, 수용액 상의 미만이다. 이는 emulsion 중합에 사용되는 계면활성제(surfactant)의 농도(일반적으로 1~5% 정도)보다 훨씬 낮으며, suspension 중합에서 더 큰 monomer droplet 의 크기가 되는 이유이다. 또한 emulsion 중합과 다르게, 2개의 상을 갖는 계(system)은 agitation 없이 suspension 중합에서 유지되지 않는다. 또 다른 차이점은 suspension 중합에서 사용되는 분산제(dispersants)는 드물게 colloidal micelle 을 형성한다. colloidal micelle 은 emulsion 중합에서는 잘 형성된다.
suspension 중합에서 사용되는 개시제는 monomer droplet 내부에서 잘 녹는다. 이러한 개시제들은 주로 지용성 개시제(oil-soluble initiators) 라 불린다. suspension 중합에서 각각의 monomer droplet 은 bulk 중합 시스템의 미니어쳐로 볼 수 있다. 각 droplet 에 대한 중합의 속도론(kinetics)은 bulk 중합에 대응되는 속도론과 동일하게 적용할 수 있다.
4-1 Emulsion Polymerization
Emulsion 중합은 일부 radical chain 중합에 사용되는 독특한 공정을 의미한다. 이는 중합이 에멀젼(emulsions = i.e. colloidal dispersions)의 형태로 일어나는 것을 말한다. 에멀젼 중합은 suspension 중합과 비슷하지만, 메커니즘과 반응 특성은 매우 다르다. 에멀젼 중합은 suspension 중합과 중합이 일어나는 더 작은 입자의 크기, 사용되는 개시제의 종류, 반응 파라미터에 대한 고분자 분자량의 의존성에서 차이점을 보인다.
Components and Their Locations
에멀젼 중합의 주요 성분은 monomer(s), 분산 매체(dispersing medium), 유화제(emulsifier) 그리고 수용성 개시제(water-soluble initiator)이 있다. 분산 매체는 유화제를 통해 다양한 성분이 분산되는 액체이고 일반적으로 물을 사용한다. 유화제가 이처럼 거동하는 이유는 분자가 친수성(hydrophilic) 그리고 소수성(hydrophobic) 성분을 모두 갖기 때문이다. 에멀젼 시스템은 반응하는 동안 일반적으로 잘 교반된 상태로 유지된다.
이제 에멀젼 시스템에서 다양한 요소의 위치들을 고려해야 한다. 에멀젼 시스템에서 계면활성제의 농도가 임계 마이셀 농도(critical micelle concentration, CMC)를 넘게되면 과량 계면활성제 분자들은 서로 뭉쳐져서 작은 colloidal cluster 를 형성하고 이를 micelle 이라 부른다. 계면활성제 농도가 CMC 를 넘어 colloidial 상태로 용액의 변하는 것은 용액의 자유 에너지를 최소화하기 위해서이다. 그리고 용액의 표면 장력의 급격한 감소에 의해 colloidial 상태로 변한다. 대부분의 에멀전 중합에서 계면활성제의 농도가 CMC 를 1배 이상 초과하기 때문에 대부분의 계면활성제는 micelle 에 존재한다. 일반적인 마이셀의 크기는 정도의 크기이고, 각 마이셀은 개의 계면활성제 분자들을 가지고 있다. 계면활성제 분자들은 micelle 안쪽으로 탄화수소 부분을 향하고 수용액상이랑 맞닿아 있는 바깥쪽 부분에 이온기를 향하게 배열되어 있다. micelle 의 수와 크기는 유화제의 양에 의존한다. 대량의 유화제를 사용하면 크기가 더 작고 더 많은 수의 micelles 가 형성된다.
물에 불용성이거나 약간 물에 녹을 수 있는 monomer 가 추가될 때, 매우 작은 양의 monomer 가 수용액 상에 용해된다. 나머지의 아주 작은 일부분은 micelles 의 탄화수소가 있는 안쪽 영역으로 들어간다. 이때 micelle 내부에 있는 monomer 의 양이 당연히 수용액 상에 녹아있는 monomer 의 양보다 훨씬 많다.
그리고 대부분()의 monomer 는 monomer droplet 의 형태로 분산되어 있다. 이때 monomer droplet 의 크기는 교반 속도(stirring rate)에 의존한다. monomer droplets 는 자신의 표면으로 흡수한 계면활성제에 의해 안정화된다. monomer droplets 의 직경은 의 범위를 갖는다. 그러므로 일반적인 에멀전 중합 시스템에서 monomer droplets 는 monomer 를 포함하는 micelle 보다 훨씬 큰 크기를 갖게 된다. 그 결과로 micelle 의 농도가 인 반면에 monomer droplet 의 농도는 대부분 정도이다. micelle 과 monomer droplet 간의 또 다른 차이점은 moicelle 의 전체 표면적이 droplet 보다 2배 이상 크다는 것이다.
Site of Polymerization
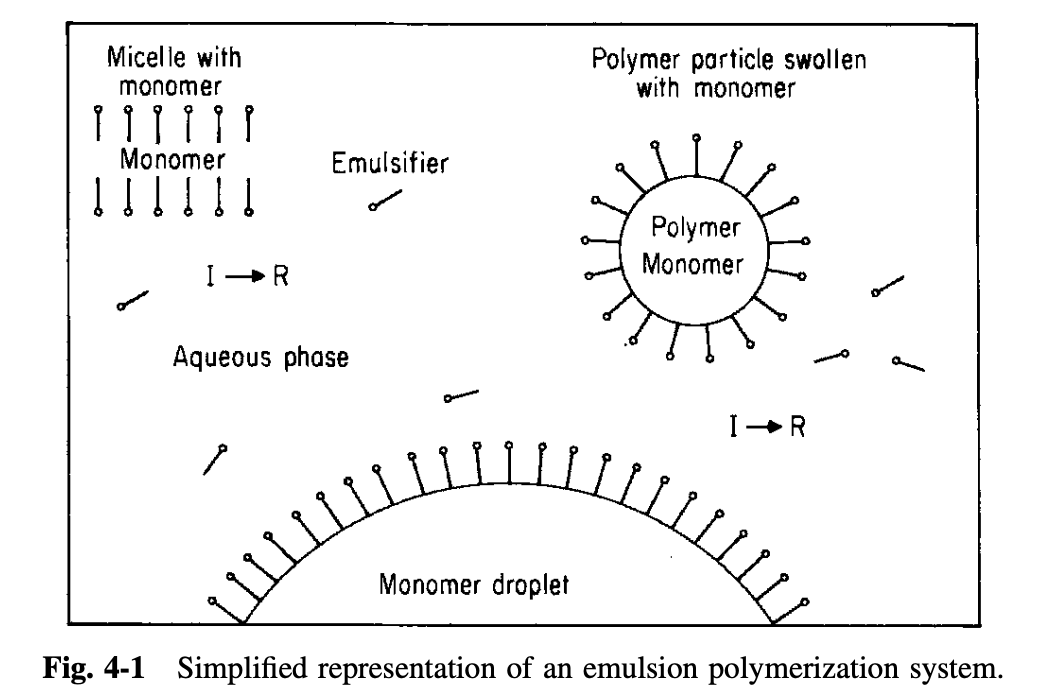
개시제는 물 속에 존재하고 여기서 개시되는 라디칼이 생성된다. 그렇다면 중합은 어디에서 일어날까? 중합이 일어나는 장소는 monomer droplet 이 아니다. 그 이유는 개시제는 유기 monomer 에 녹지 않기 때문이다. 이러한 개시제를 oil-insoluble initiators 라 부른다. 이러한 점도 에멀전 중합과 suspension 중합을 구분하는 요소이다. suspension 중합에서 사용되는 지용성 개시제는 monomer droplet 안에서 반응이 일어난다. 에멀전 중합의 중합이 일어나는 장소가 monomer droplet 이 아님은 실험적으로 밝혀진 사실이다. 완전환 전환률(conversion)에 도달하기 전에 적절한 지점에서 에멀전 중합을 중단시키면, monomer droplets 를 분리하여 분석할 수 있다. 그 결과 monomer droplet 안에는 약 의 고분자가 존재했었다. 그렇기에 에멀전 중합에서 중합은 micelles 안에서 대부분 일어난다. 또한 monomer droplets 는 micelles 에 비해 용액 안에서 생성된 라디칼을 잘 잡아두지 못한다. 그 이유는 micelles 의 전체 표먼적이 훨씬 크기 때문이다.
용액 속에서 monomer 의 중합이 일어난다는 것은 틀림없지만, 이것이 고분자를 형성하는데 기여하지는 못한다. 그 이유는 monomer 의 농도가 매우 낮고 propagating 라디칼이 수용액 상에는 매우 작은 크기(oligomeric)로 존재하기 때문이다. micelles 는 지용성인 유기 monomer 와 수용성인 개시제가 만나는 장소의 역할을 한다. micelles 는 수용액 상의 monomer 에 비해 더 많은 monomer 농도를 갖기 때문에 반응 장소(reaction site)로 선호된다. 중합 반응이 진행되면서 수용액 상에 존재하는 monomer 가 micelles 으로 이동하면서 점점 성장하게 된다. 이때 수용액 상의 monomer 농도는 monomer droplets 가 분해되면서 보충된다. 이러한 에멀전 중합 시스템은 맨 위 Fig. 4-1 로 간단히 나타낼 수 있다. 에멀전 중합 시스템은 크게 세 종류의 입자로 구성되어 있다 : monoomer droplets, 중합이 일어나지 않는 inactive micells, 중합이 일너나는 active micelles. 후자의 경우는 더 이상 micelles 로 보지 않고 polymer particles 로 보기도 한다. 유화제 분자들은 로 표기하고, 는 극성 또는 이온기를 의미한다. 그리고 다른 는 비극성을 의미한다.
Progress of Polymerization
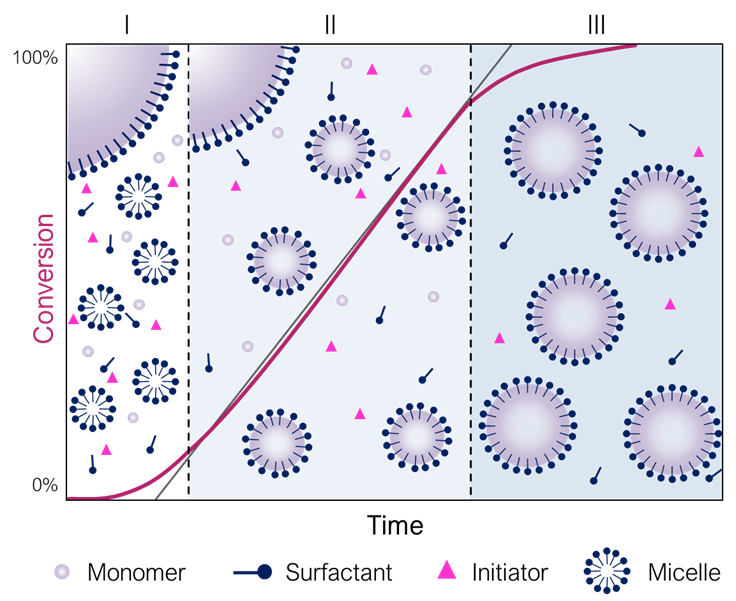
particle 의 수는 구간 에서 증가하고 구간 와 에서 일정하게 유지된다. Particle nucleation 은 구간 에서 일어나고 시간에 대한 중합 속도도 크게 증가한다. 즉, monomer 가 확산에 의해 polymer particle 내부로 이동하게 된다. polymer particles 가 성장하여 크기가 커지고 monomer 뿐만 아니라 polymer 도 포함하게 되어 polymer particles 는 안정성을 유지하기 위해 수용액에 존재하는 더 많은 계면활성제들을 흡수한다. 이 지점에 빠르게 도달하게 되고, 이때 CMC 이하로 용액 속의 계면활성제 농도가 떨어지게 되고, inactive micelles 는 불안정해지고 구성하던 계면활성제가 분해되어 사라지게 된다. 구간 이 끝나는 지점(혹은 구간 의 시작 지점)에서 시스템에 존재하는 모든 또는 대부분의 계면활성제는 polymer particles 에 흡수된 상태가 된다. 그 결과로 monomer droplets 는 상대적으로 불안정해지고 교반이 멈추게 된다면 서로 응집할 것이다. 구간 은 일반적으로 3개의 구간 중 가장 짧은 구간이고, 전환률 동안 일어난다. 구간 은 정상 상태(steady-state) 입자의 수를 얻는데 더 많은 시간이 필요하므로 시작 속도가 느린 경우 더 길어진다. vinyl acetate 와 같은 수용성 monomer 가 물에 녹지 않는 monomer 를 사용했을 때보다 구간 이 더 빨리 끝난다. 이는 아마도 micelle 핵 형성과 동시에 균일 핵 형성(homoegeneous nucleation)이 상당 부분 발생하여 정상 상태 입자 수에 더 빨리 도달했기 때문이다.
구간 에서는 micelle 내부(polymer particles)에서만 성장하는 propagation 이 일어난다. 이때 polymer particles 안의 monomer 농도는 용액에 존재하던 monomer 의 확산(diffusion)과 monomer droplet 에서 monomer 가 용해되어 평행 상태(= saturation, 포화 상태)로 유지된다. 이때문에 일정한 속도로 중합이 진행되는데, 이는 급격한 반응이 일어지 않아 중합 시스템을 제어하기 쉽게 만든다. 결국, monomer droplets 이 전부 소멸하면서 polymer particles 의 크기는 점점 커진다.
구간 에서 으로 전환은 monomer 의 수용성이 증가하고 polymer particles 의 팽창 정도가 증가함에 따라 더 낮은 전환율에서 발생한다. 예를 들어 vinyl chloride 같은 monomer 들은 낮은 수용성을 갖고 몰랄 부피 이 낮기 때문에, 의 전환율에서 구간 에서 으로 전환된다. 하지만 styrene 이나 butadiene 은 의 전환율에서 전환된다.
입자의 수는 구간 나 이나 동일하게 유지된다. 하지만 monomer 농도는 시간에 따라 감소한다. 그 이유는 monomer droplet 이 더 이상 존재하지 않기 때문이다. 또한 구간 에서 gel effect 가 나타나기도 한다. 결국 중합은 polymer particles 내부의 monomer 농도가 감소하면서 일정하게 속도가 감소하며 일어나고 결국 중합 반응이 전환율에 다다르면 종료된다. 최종 생성물인 고분자 입자는 구형을 띄며 일반적으로 지름이 %40-300 \text{nm}$ 이다. 이는 최초의 micelles 와 monomer droplets 사이의 중간체 정도의 크기이다.
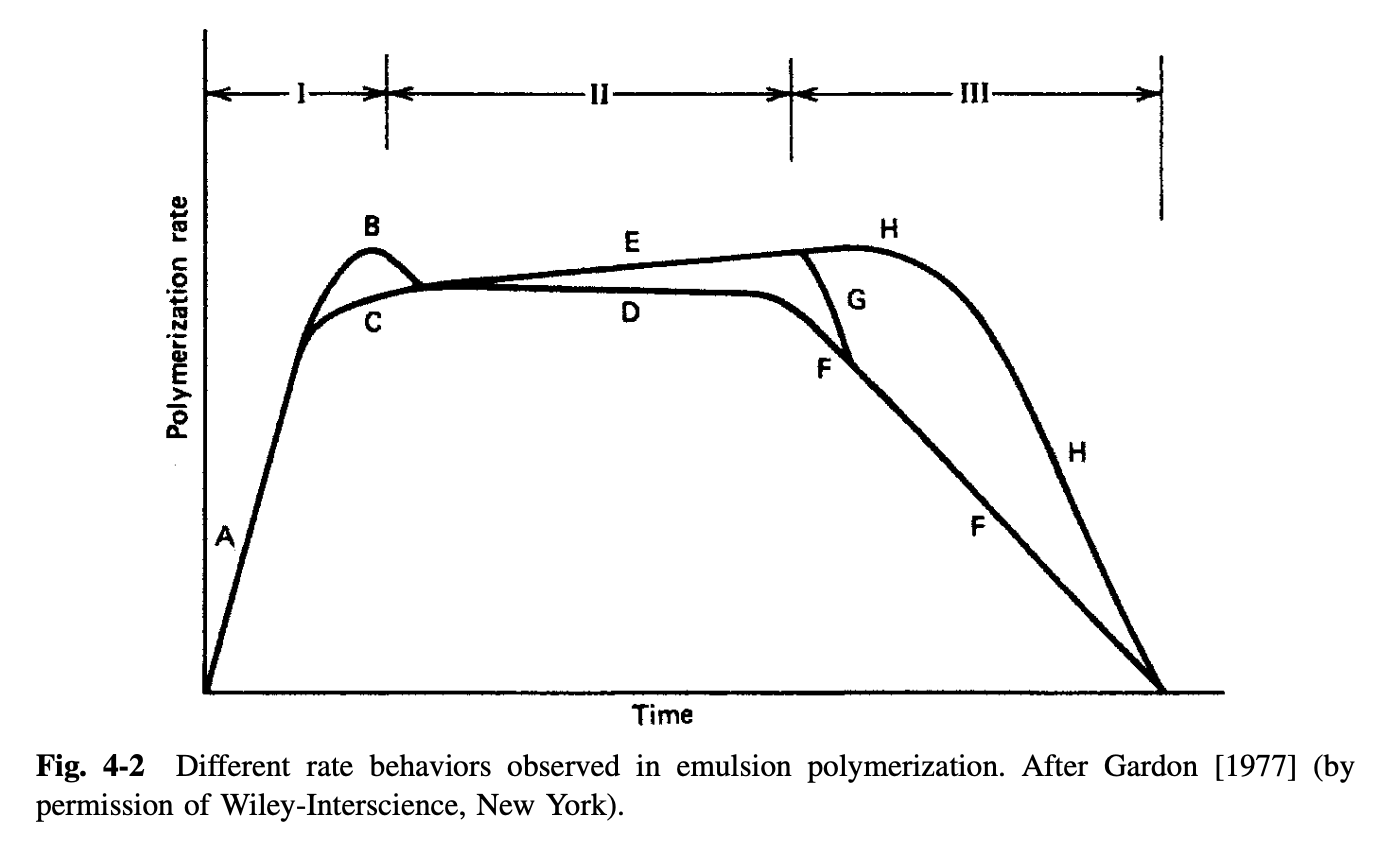
에멀전 중합의 시간에 따른 conversion 변화를 나타낸 상단의 그래프를 시간에 따른 , 중합 속도의 변화를 나타낸 그래프로 그리면, 아래와 같다.
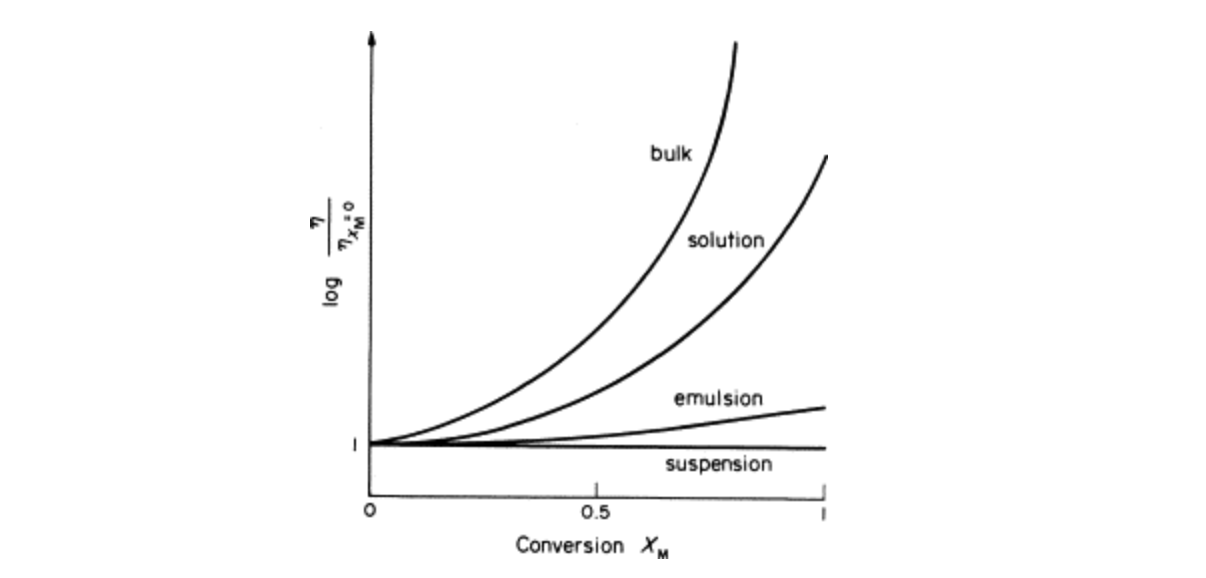
또한 아래의 그래프는 여러 중합에서 시간에 따른 점도 변화를 나타낸 것이다. 불균일계 중합이 균일계 중합보다 점도 변화가 크지 않기 때문에 공정 제어에 용이하다는 장점을 갖는다는 것을 확인할 수 있다.