(Review paper) Deep learning in cancer pathology: a new generation of clinical biomarkers
Paper review
Deep learning in cancer pathology: a new generation of clinical biomarkers (British Journal of Cancer. 2021)
(https://www.nature.com/articles/s41416-020-01122-x)
이 review paper는 cancer pathology에서 Deep Learning (DL)이 어떻게 임상 바이오마커의 새로운 세대를 탄생시키고 있는지에 대해 리뷰.
추가적으로 2021년 리뷰 논문이긴 하지만 어떤 방향으로 모델의 결과를 보여주는 것이 임상적으로 의미가 있을지 탐구하기.
Abstract:
- 현재 cancer biology에서는 predictive and prognostic molecular biomarkers 에 크게 의존하고 있음. 이러한 바이오마커들은 임상 실무에서 결정을 내리는 데 필요한 시간과 비용을 증가시킬 뿐만 아니라, 종종 표준 진단 자료 외에 추가적인 종양 조직을 요구함.
- 종양 조직에는 현재 충분히 활용되지 않고 있는 임상적으로 중요한 정보가 풍부하게 들어 있음. (이 리뷰는 2021년 현재는 많이 사용되는중)
- 딥러닝과 같은 인공지능 기술의 발전은 이러한 histology 이미지로부터 이전에는 감춰져 있던 정보를 추출할 수 있게 함으로써, 임상적으로 유용할 수 있는 정보를 제공함.
- 기본 이미지 분석 작업은 histology images에서 detection, grading and subtyping of tumour tissue 등을 포함하며 histology workflow 자동화를 목표로 함.
- 이러한 기본적 접근법을 넘어서, 딥러닝은 inference of molecular features, prediction of survival and end-to-end prediction of therapy response 예측 등 advanced approach에도 사용되었음.
- 이러한 advanced approach 방식은 임상 결정 과정에 직접적인 영향을 줄 수 있는 잠재력을 가지고 있으며, 딥러닝 시스템에 의해 이루어진 예측은 임상 결정을 단순화하고 풍부하게 만들 수 있지만, 임상 설정에서 엄격한 external validation이 필요하다.
Background:
이 논문의 배경 부분은 암 병리학에서의 딥러닝(DL) 응용과 그 임상적 의의를 탐구하는 데 초점을 맞추고 있음.
The complexity of cancer treatment decisions
- 암 치료에 있어서 의사 결정 과정은 점점 더 복잡해지고 있으며, 이는 점점 더 많은 수의 바이오마커들이 사용되고 있기 때문이다. 이러한 바이오마커들은 치료 권장 사항의 복잡성을 증가시킨다.
- 현재 사용되고 있는 분자 바이오마커는 prognostic 또는 predictive 적일 수 있다. Prognostic biomarker는 환자를 질병의 진행 위험도에 따라 분류하는 데 사용될 수 있으며, predictive biomarker는 특정 환자 그룹에 대한 타겟 치료를 선택하는 데 도움이 된다.
Biomarker 임상 응용 ex
- Stage II colorectal cancer (CRC, 대장암): 2기 대장암에서 microsatellite instability (MSI)는 prognostic biomarker로 사용되며, MSI가 검출된 경우 더 낮은 치료 강도의 보조 화학요법이 사용될 수 있다. 반면, treatment-refractory stage IV CRC에서 MSI는 immune-checkpoint-inhibitor-based immunotherapy에 대한 FDA 승인된 prediction biomaker 이다.
- Breast cancer: 유방암에서 HER2 양성이 검출되면 환자는 항 HER2 제제로 치료할 수 있으므로 이 질환에서 강력한 예측 바이오마커로 작용한다.
- Non-small-cell lung cancer(NSCLC): EGFR 유전자와 다른 유전자의 변이, anaplastic lymphoma kinase (ALK) 또는 기타 drivers의 유전자 융합, PD-L1의 과발현 등 다수의 분자 바이오마커가 표준 치료를 위해 필요함.
Potential of deep learning & Innovation
- 딥러닝은 복잡한 데이터셋에서 반복되는 패턴을 식별하는 데 사용되는 인공 지능의 한 방법이다. 특히, 이미지 데이터는 높은 정보 밀도를 가지고 있어 DL 기술 분석에 이상적이다.
- DL은 neural networks 사용하여 복잡한 데이터 세트에서 반복되는 패턴을 식별하는 인공 지능(AI) 영역의 방법입니다.
- Radiology: 딥러닝은 흉부 CT 이미지에서 종양 탐지나 장기 분할과 같은 반복적인 작업을 인간과 같거나 더 나은 성능으로 수행함. FDA에서는 이미 여러 딥러닝 방법을 임상 사용에 승인하였습니다.
- MRI: MRI 데이터는 CT 데이터보다 훨씬 많은 정보를 담고 있으며, Dl based mining에 적합.
- Non-radiology tasks: 딥러닝은 실시간 내시경 이미지 분석, 피부암 검출 등 비라디올로지 작업에서도 좋은 성능을 보여줌.
Importance of histology image
- Histology image는 routine clinical practice에서 파생되며, 방대한 양의 정보를 담고 있다. 이 이미지들은 방대한 수의 세포를 표현할 수 있으며, 이들 세포의 형태학과 공간적 배열은 다른 의료 이미지보다 훨씬 더 많은 정보를 담고 있다.
- Histology slide image는 픽셀의 관점에서 훨씬 더 크며, 이로 인해 더 많은 정보를 담을 수 있다. 이러한 고정보 밀도는 histology image를 딥러닝 기반의 바이오마커 추출에 매우 매력적인 요소로 만든다.
이 리뷰 논문은 딥러닝이 cancer histology 분야에서 어떻게 응용될 수 있는지, 그리고 이러한 연구가 임상 환경에서 어떻게 유익하게 사용될 수 있는지에 대한 명확한 개요를 제공. 또한, clinical setting으로의 성공적인 전환을 위해 필요한 가능한 사용 사례와 후속 조치에 대해 논의함.
Deep-learning-based analysis of histology images
Basic and advanced applications of DL in cancer histology
- Basic DL applications:
- 현재 인간 병리학자에 의해 전적으로 수행되는 routine workflows를 단순화하는 것을 목표
- 예를 들어, 생검 샘플에서 종양 조직을 탐지하거나, morphology에 기반한 tumour subtyping 같은 작업이 이에 해당함.
- 이러한 기본 DL 응용은 병리학 부서의 비용과 처리 시간을 줄일 수 있는 잠재력이 있지만, 임상의들이 치료 사항을 결정하는 데 사용하는 최종 결과에는 변화를 주지 않는다.
- Advanced DL applications:
- Go beyond the standard reporting that is currently performed by pathologists
- 예를 들어, H&E로 염색된 조직 슬라이드에서 직접 유전 변이와 생존을 예측하는 것이 이에 해당.
- Advanced DL applications은 clinical workflow에서 현재 루틴 자료로부터 추출되지 않는 추가 정보를 임상의에게 제공할 수 있으며, 이는 새로운 종류의 바이오마커로서 잠재적인 예후 및 예측 정보를 제공함.
- 즉 advanced DL applications은 유전적 변이 예측, 생존율 예측, 특정 치료에 대한 반응 예측 등을 포함하여, 현재의 임상 워크플로우에서는 활용되지 않는 새로운 정보를 제공함.
- 이러한 advanced DL applications은 임상의가 현재 임상 워크플로우에서 활용하지 않는, 루틴 자료로부터 얻을 수 없는 추가적인 정보를 제공함으로써, 새로운 바이오마커의 형태를 창출한다. 이는 암 치료의 개인화를 실현하는 데 중요한 기여를 할 수 있으며, 특히 유전적 변이나 치료 반응성과 같은 중요한 임상 정보를 예측하는 데 사용될 수 있다.
Basic applications of DL: tumour detection, grading and subtyping
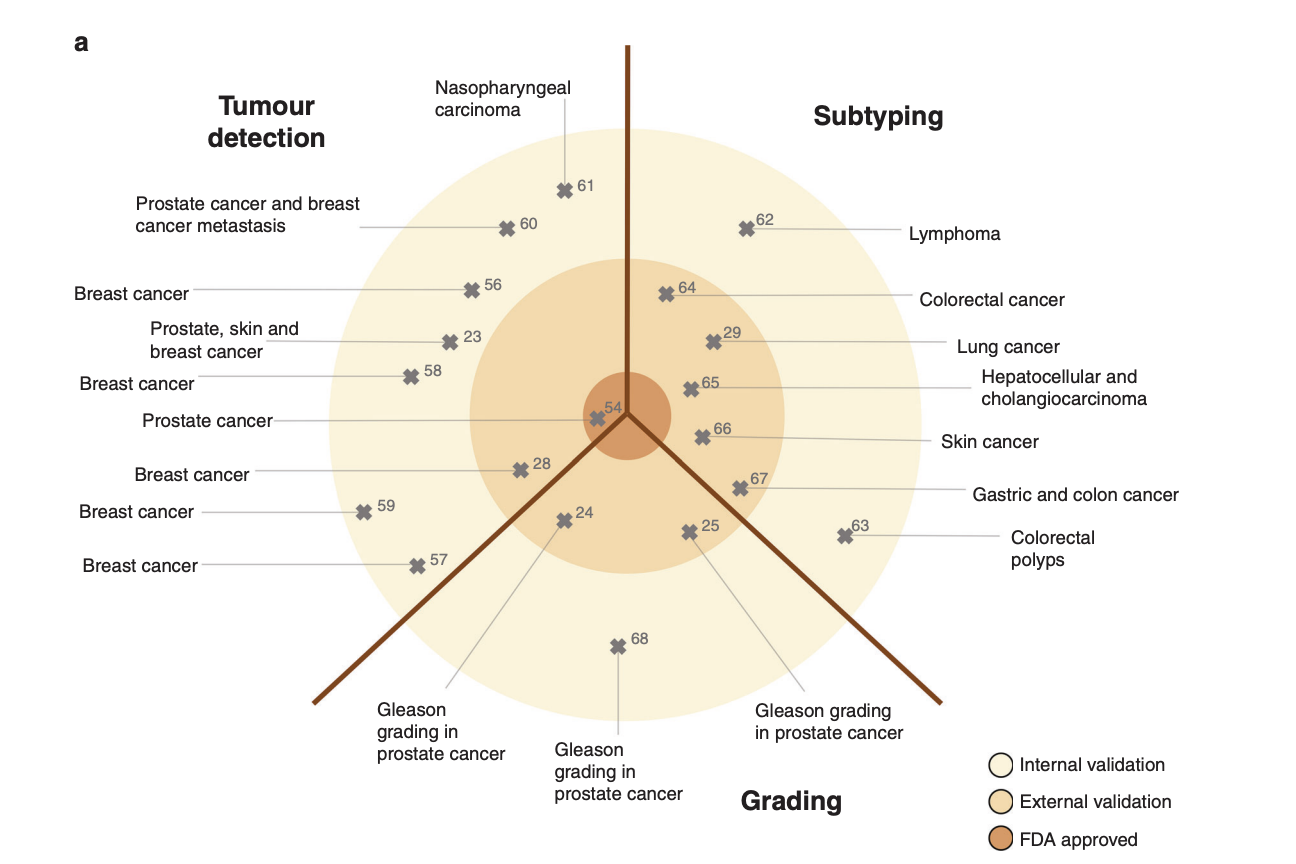
- Automating histopathology workflows by DL
- 디지털 병리학에서 DL은 tumour detection, tumour subtyping, quantification of cell numbers and classification of cell types 같은 기본적인 이미지 분석 작업을 자동화하는 데 사용되고 있다.
- 이러한 DL 기반 tumour detection는 병리학에서 수동으로 수행되는 반복적인 작업을 자동화할 수 있으며, 다양한 종류의 종양에 대해 높은 성능을 보여줌. (여러 연구들을 통해 전문 병리학자와 유사한 수준의 정확도로 작업을 수행할 수 있음이 입증되었음)
- 그러나 이러한 시스템이 비용 절감이나 처리 시간 단축을 가져올 수는 있지만, 드문 경우를 제외하고는 전문가 수준의 감도와 특이도를 향상시키지는 못함.
- 따라서, 이러한 기본 DL 시스템은 병리학 실습 방식에 큰 변화를 가져올 수 있지만, 즉시 임상 워크플로우나 암 환자의 치료 전략에는 변화를 주지는 않는다는 점에서 임상의에게 제한적인 관심사이다.
- Clinical-grade validation of basic DL methods
- 디지털 병리학에서 기본 딥러닝(DL) 시스템을 개발하는 가장 큰 도전 중 하나는 그들의 임상적 검증이다. 하나의 데이터셋만을 사용하여 방법을 개발하고 검증하는 것은 오버피팅의 위험을 가지며, 특정 환자 코호트에서는 잘 작동하지만 외부 코호트로 일반화하지 못하는 DL 시스템을 만들 수 있다.
- 따라서, 이상적으로는 multicentre 데이터셋에서 external 데이터셋을 사용하여 DL 시스템을 검증하는 것이 그것의 최종적인 일상 사용과 규제 승인을 위해 매우 중요하다.
- 지난 2년 동안, multicentre를 포함하는 대규모 연구가 증가하고 있으며, 이러한 연구들은 전립선암 검출 및 등급 분류를 위한 DL 시스템이 병리학자 수준의 성능을 보이며 큰 환자 코호트에서 외부 검증을 받는 것을 보여주었다.
- 중요한 점은 DL 시스템의 성능이 훈련 데이터셋의 환자 수가 증가함에 따라 향상되고, 10,000~15,000개의 조직 전체 슬라이드 이미지에 대한 훈련 후 성능이 일정 수준에 도달한다는 것.
- 이는 충분한 성능을 가진 DL 시스템 개발을 목표로 할 때 엄청난 양의 이미지와 데이터가 필요함을 시사함.
Advanced applications: prediction of mutations, survival and response from histology
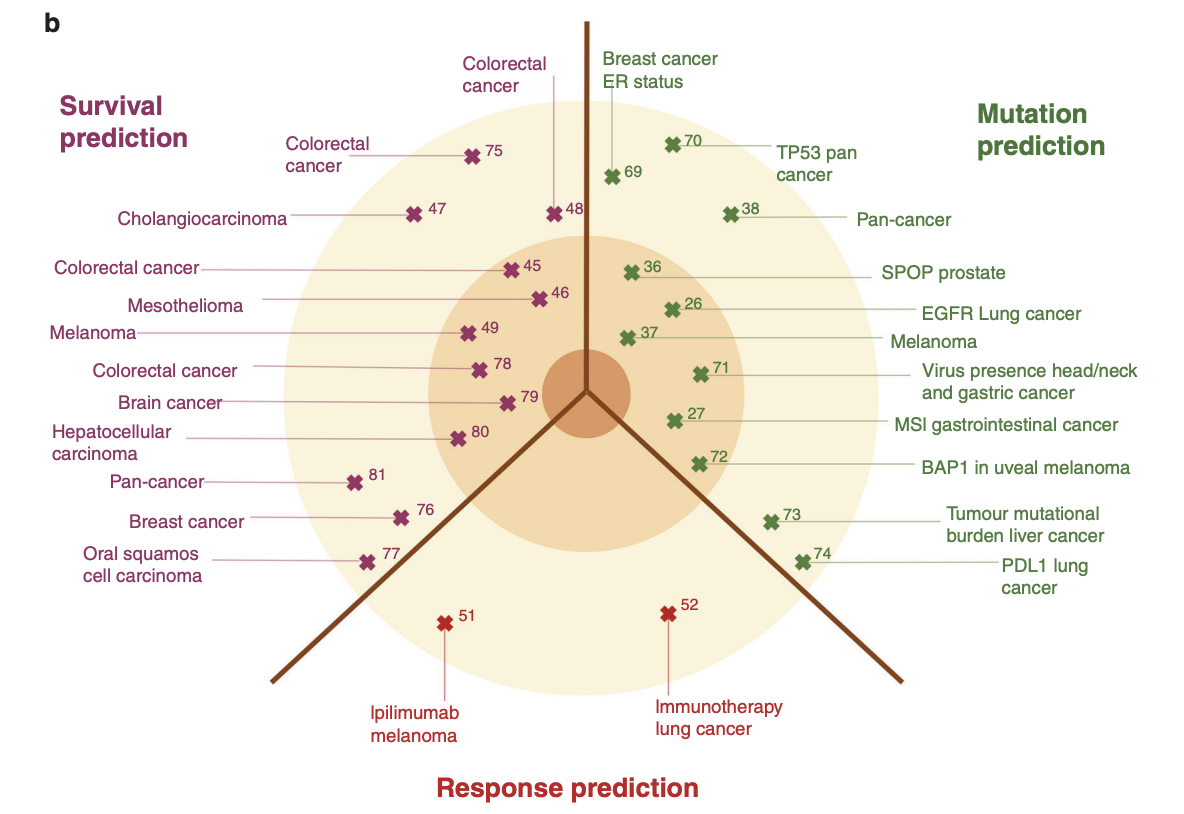
- Moving beyond basic applications of DL in histology image analysis
- 현재 histology image에 포함된 풍부한 정보는 종양학에서 치료 결정을 안내하는 데 체계적으로 활용되지 않고 있다.
- 최근 연구들은 조직학 이미지로부터 직접 high-level label을 추론하는 DL의 사용을 통해 이러한 정보의 풍부함을 보여주었다.
- 이 high-level label은 인간 전문가가 조직학 이미지를 관찰하여 신뢰성 있게 추론할 수 없는 것들이며, 통상적인 조직병리학 외에 다른 방법이 필요하다. 특히, inference of genetic alterations, prediction of survival and prediction of treatment response과 같은 세 가지 주요 영역에서 조직학 이미지로부터 직접 임상적으로 관련된 라벨을 예측하는 데에 점점 더 많은 초점이 맞춰지고 있다.
- 기본 이미지 분석 기술과 달리, 이러한 advanced DL은 임상 의사 결정을 직접적으로 변경할 잠재력을 가지고 있다.
-
Prediction of genotype and gene expression
-
딥러닝은 종양 조직의 미세한 모양 변화를 통해 암을 유발하는 유전자 변이의 존재를 신뢰성 있게 탐지할 수 있음을 보여주었다다. 암세포의 핵과 세포질의 질감, 크기 및 형태와 같은 변화뿐만 아니라, 암세포가 주변 non-malignant 세포 (암세포이긴 하지만 분열하지 않는 세포) 에 유발하는 반응을 통해 생기는 두 번째 순서의 형태학적 변화도 포함된다. 이러한 변화는 각각의 암 유발 유전자 변이에 의해 발생하지만, DL을 사용하여 H&E 이미지에서 직접 이러한 유전자의 유전형을 예측할 수 있음이 입증되었다. 예를 들어, 폐선암에서 암 유전형이 조직학적 형태현상에 반영됨을 보여주는 연구가 있었다. 이 연구에서는 특정 유전자 변이(STK11, TP53, EGFR)를 조직학만을 사용하여 예측할 수 있었으며, AUROC 값이 0.85에 이르는 것을 검증했다.
-
이러한 유전자 변이의 예측은 targeted therapy에 중요하다. 예를 들어, 폐암에서 EGFR의 유전형은 변이된 EGFR 단백질을 표적으로 하는 여러 tyrosine kinase inhibitors (TKI)의 사용을 지시하며, 멜라노마에서는 변이된 BRAF가 세린/트레오닌 키나제 억제제로 직접 표적화된다. 또한, MSI, the genetic correlate of mismatch-repair deficiency (dMMR)의 유전적 상관인 MSI는 immune-checkpoint inhibition therapy 사용을 위한 몇 안 되는 FDA 승인 유전적 바이오마커 중 하나이다. 이러한 변이는 조직학만으로도 위암, 대장암, 자궁내막암에서 신뢰성 있게 탐지될 수 있다.
-
현재 임상에서 암 조직의 유전적 변화를 탐지하는 것은 IHC, ISH, PCR 또는 차세대 시퀀싱(NGS)과 같은 wet-lab 검사가 필요하지만, 이러한 검사는 비용이 많이 들고 시간이 오래 걸리며, 모든 암 치료 지점에서 사용할 수 있는 것은 아니다. 반면, DL을 기반으로 한 스캔된 조직학 슬라이드 평가는 추가 비용이나 시간이 거의 들지 않는다. 그러나 지금까지 수행된 모든 DL 기반 연구에서, AUROC score는 sample크기에 따라 많이 다르고, wet-lab test의 gold standard에 비해 일관되게 열등했다. (현재는 성능이 어떤지 모르겠네)
-
-
Survival prediction through DL biomarkers
-
딥러닝(DL) 바이오마커를 통한 생존 예측은 종양학의 치료 결정 과정에서 중요한 요소이다. 현재 생존율은 age, gender, cancer stage, pre-existing conditions, genetic alterations and histology risk factors를 통해 추정된다. 이러한 조직학적 위험 요인에는 거의 모든 종양에서 발견되는 tumour cell differentiation, stromal abundance, lymphocyte fraction, lymphatic vessel invasion, vascular invasion, perineural invasion and necrosis 등이 포함된다.
-
이러한 기존 위험 요인 외에도, 더 높은 수준의 특성들이 예후 정보를 담고 있다. 예를 들어, 림프구의 공간적 배열 분석이나 염색질 질감과 같은 특성은 다양한 종양에서의 생존율 예측 지표로 사용될 수 있다. DL은 이러한 특성을 모두 통합하여 이미지 데이터로부터 직접 생존율을 예측할 수 있는 잠재력을 가지고 있으며, 이는 여러 연구에서 입증되었다.
-
일부 연구에서는 생존 예측자를 위해 DL 네트워크를 훈련시키기 위해 수동으로 정의된 파라미터를 사용한 반면, 다른 연구에서는 unbiased approach and leave the feature selection entirely to the deep network을 사용했다. 이는 조직 예후 파라미터가 수동으로 식별되거나 추출되지 않았음을 의미함. 이러한 접근 방식은 모두 임상 설정에서 위험 조정 전략의 기반으로 사용되기 위해서는 독립적이고 전향적으로 검증될 필요가 있다. (실제로 요즘 unsupervised learning 많음)
-
DL 기반 생존 예측을 탐색하는 몇 가지 주요 연구는 다양한 암 유형에서 이루어졌음. 예를 들어, H&E 염색된 조직만을 사용하여 대장암 환자의 5년 질병 특이적 생존율을 예측하는 것이 가능함을 보여준 연구가 있었고, 또한, 조직 분류를 통한 OS예측을 통해 기존 방법보다 개선된 생존 예측이 대장암 환자에서 입증되었다.
-
그러나 아직까지 DL 기반 생존 예측을 임상 워크플로우에 통합한 임상 종단점 연구는 없으며, 다른 예후 바이오마커를 사용한 대규모 전향적 시험은 평가되었지만 DL 문헌에서는 이러한 수준의 증거가 여전히 부족. DL 기반 테스트가 임상 의사 결정에 직접적인 영향을 미치고 새로운 치료 개발 목표를 식별하는 데 도움이 될 수 있는 잠재력을 가지고 있음에도 불구하고, 이 분야는 여전히 초기 단계. (점차 많아지고 있음)
-
-
End-to-end response prediction directly from histology
-
DL을 이용한 치료 반응 예측은 다양한 암 유형에 대한 표적 치료 옵션의 증가와 함께 중요해지고 있다. 많은 치료법이 특정 환자 집단에서만 효과적이며, 반응하지 않는 환자들에게는 상당한 부작용을 일으킬 수 있음. 예를 들어, cancer immunotherapy은 멜라노마와 폐암 치료 분야를 혁신적으로 변화시켰지만, 여전히 이러한 종류의 종양을 가진 환자의 약 절반은 의미 있는 반응을 보이지 않는다. DL은 치료에 대한 긍정적 반응의 예측 마커로 사용될 수 있는 종양 조직 내의 구조와 변화를 탐지하는 데 핵심적인 역할을 할 수 있으며, 따라서 반응하는 환자를 식별하고 비반응자에 대한 부정적인 영향을 최소화하는 데 도움이 될 수 있다.
-
DL을 일상적인 조직학 이미지에 적용하여 긍정적인 예측 마커를 탐지/식별하는 두 가지 잠재적 방법이 있다.
-
첫째, DL은 이미 치료 접근법의 대상이거나 치료 반응의 대리인으로 알려진 특성, 변이, 호르몬 수용체 상태 또는 유사한 분자 변화를 식별할 수 있다. 이 접근법은 환자를 더 빠르고 정확하게 최적의 치료 체계에 할당하는 데 도움이 될 수 있다.
-
또한 조직 슬라이드로부터 직접 치료 반응을 예측하는 데 사용될 수 있다. 이 end-to-end workflow는 특정 치료 반응 유형이 알려진 대규모 환자 코호트에 대해 DL 네트워크를 훈련시키는 것을 요구. 하지만 이러한 이미지 데이터는 쉽게 얻을 수 없기 때문에, 이를 조사한 연구는 많지 않음.. 특히, 멜라노마 환자를 ipilimumab에 대한 반응자와 비반응자로 분류한 연구, 그리고 H&E 염색 이미지로부터 직접 NSCLC 환자의 면역요법에 대한 반응을 예측하는 연구가 있었지만, 이 연구들은 소규모 환자 수를 포함하고 있으며, DL이 치료 반응을 예측하는 잠재력이 아직 완전히 활용되지 않았음. 생존 예측과 유사하게, 치료 반응 예측은 조직학 이미지에서 새로운 형태학적 마커의 탐지로 이어질 수 있으며, 이는 새로운 치료 전략의 개발로 이어질 수 있음. (내가 생각했을 때도 가장 중요한 전략, 사업적으로도 진단하기에 가장 많은 비용이 드는 부분이기에..)
-
Implementation of DL biomarkers in clinical workflows
-
DL-based mutation prediction for pre-screening or definitive testing
-
DL 기반 바이오마커는 임상 워크플로우에 두 가지 주요 방식으로 통합될 수 있다.
-
환자의 유전자 검사 전 사전 선별이나 결정적 검사를 위한 변이 예측이다.
-
대부분의 암 유형에 대한 임상 워크플로우는 치료를 조정하기 위해 분자 검사에 의존하고 있지만, 실제 제한으로 인해 보편적인 검사는 불가능하다.
-
DL 기반 유전자형 판정은 이러한 워크플로우에서 환자를 유전자 검사 전에 사전 선별하는 데 사용될 수 있거나, 기존 방법을 완전히 대체하여 결정적 검사로 사용될 수 있다. 이 경우, 매우 높은 검사 성능이 요구된다. DL에 대한 증명 개념 연구는 대체로 0.70–0.90 범위의 AUROC 값을 보고했으며, 이는 확실히 결정적 검사에 필요한 것보다 낮지만, 드문 특성의 환자를 사전 선별하는 데 유용할 수 있음.
-
-
Moving towards clinical approval: where are we now?
-
DL의 임상 승인 방향은 아직 초기 단계에 있으며, 방사선학 분야에 비해 조직병리학에서의 응용은 천천히 진행되고 있다. 그러나, 연구 환경은 기술 중심에서 벗어나 점점 더 임상적으로 관련된 문제와 과제에 초점을 맞추고 있다. 일부 DL 개념은 규제 기관으로부터 승인을 받고 임상에 적용되기 시작했지만, 조직병리학 이미지 분석에서 FDA 승인된 절차는 기본 DL 응용에 국한되어 있다.
-
DL 조직학을 임상에 널리 도입하기 위해서는 표준화가 필요하고 임상에서 사용될 수 있을 만큼의 성능을 더욱 개선해야 함.
-
-
Moving towards end-to-end systems
-
End-to-end DL 시스템은 특정 치료에 대한 반응을 직접 예측하려는 대안적 접근 방식으로 제안되었다. 이는 유전적 바이오마커가 치료 반응을 예측하는 대리 지표로 사용될 수 있지만, 모든 경우에 완벽한 예측 값을 제공하지는 않는다는 인식에서 출발.
-
예를 들어, HER2의 변이나 over expression은 유방암에서 트라스투주맙에 대한 긍정적인 반응을 예측하지만, 다른 분자 바이오마커들은 그렇게 명확하지 않다. End-to-end 시스템은 특정 치료 유형에 초점을 맞추지 않고 조직학 이미지만을 바탕으로 개별 환자의 생존율이나 치료 반응을 예측할 수 있는 잠재력을 가지고 있으며, 이론적으로는 미리 정의된 예측 파라미터에 집중하지 않고 조직학 이미지로부터 직접 결과를 예측할 수 있기 때문에 분자 예후나 예측 바이오마커보다 더 우수한 성능을 발휘할 수 있다.
-
