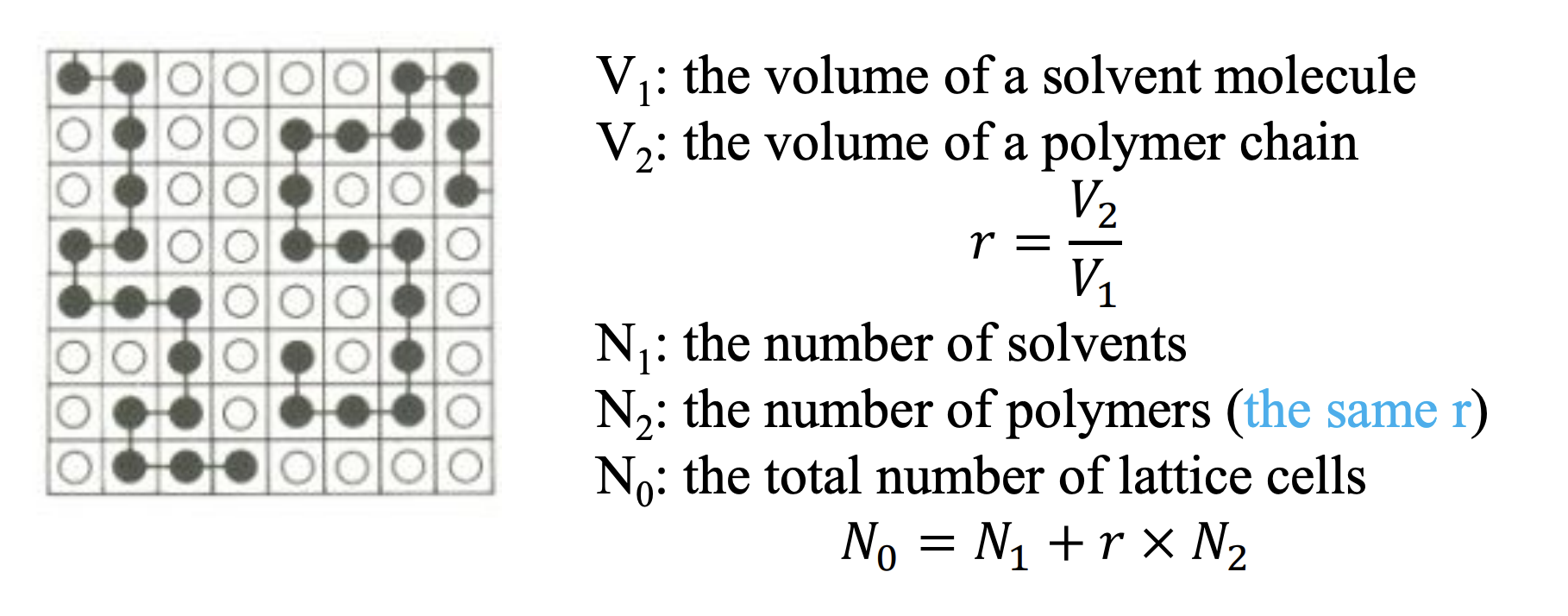Introduction
열역학에서 enthalpy와 entropy를 고려하여 Gibbs free energy, G는 다음과 같이 나타낸다.
그럼 2개 system을 섞는다고 가정하면, 섞은 후의 G와 섞기 전의 G의 차이인 ΔGM는 다음과 같다.
ΔGM=G12−(G1+G2)
이 때 homogeneous solution은 ΔGM<0이여야 얻을 수 있을 것이다. 이번 시간에는 small molecules의 mixing은 열역학적으로 어떻게 구했는 지 알아보고 polymer의 경우에는 small molecules의 mixing 식이 아닌 다른 식이 유도되는 이유와 과정을 Flory-Huggins Theory를 통해 알아보고 polymer solution의 깁스 자유 에너지 변화량을 나타내는 Flory-Huggins equation에 대해 배워보자.
Ideal Mixing
polymer mixing을 알아보기 전에 small molecules의 ideal mixing을 우선 알아보자. 우선 ideal하다는 의미는 분자 간의 상호작용이 분자의 종류에 무관하기에 오직 entropic effect만 고려하겠다는 의미와 서로를 당기거나 밀어내는 intermolecular force가 동일하다는 것이다. 이 때 우리는 열역학적 정의에 의한 entropy의 정의를 사용할 것이다. 이는 이전 시간에 배웠듯이 다음과 같다.
S=klnΩ
Assumptions
ideal mixing이기에 몇 가지의 가정을 고려하자. 이는 다음과 같다.
- 두 분자를 섞었을 때, 부피의 변화가 없다. 즉, ΔVm=0.
- 분자들의 크기는 동일하다.
- entropic effect만 고려하기에, enthalpy의 변화가 없다. 즉, ΔHm=0.
- 평형 위치에 대한 component의 움직임은 섞은 후에도 변하지 않는다.
Configurational Entropy
엔트로피를 Ω, 경우의 수로 설명하기에 이를 알아보자. 우선, 섞기 전에는 component(molecules)간의 가능한 경우의 수는 1이다.
그럼 섞은 후에는 어떻게 될까? N1+N2≡N0라 하자. 그럼 이 때, component의 가능한 경우의 수 Ω는 고등 수학 때 배운 조합을 떠올려보면, 다음과 같다.
Ω=N1!N2!(N1+N2)!=N1!N2!N0!
이렇게 섞은 후의 경우의 수를 고려하여 mixing 후의 구성(공동 구조)를 가정한 entropy를 configurational entropy(Sc)라고 한다. Ω를 그대로 S에 대입해주면,
Sc=klnN1!N2!N0!=k(lnN0!−lnN1!−lnN2!)
Approximation
Stirling's Approximation : lnN!=nlnN−N
위 과정을 이용하면, configurational entropy는 다음과 같다.
Sc=−k(N1lnN0N1+N2lnN0N2)
ΔS and ΔG for mixture
섞기 전 가능한 경우의 수는 1이였으므로, component i에 대한 경우의 수는 Si=kln1=0이다. 섞은 후의 엔트로피는 configurational entropy, Sc라 하였다. 그러므로 ΔSidealM은 다음과 같다.
ΔSidealM=Sc−S1−S2=Sc
여기서 mole fraction을 사용하여, xi=N0Ni라 하면,
ΔSidealM=−k(N1lnx1+N2lnx2).
만약, 단위 lattice 당 ideal mixture의 entropy의 변화량을 알고 싶다면, 전체를 N0로 나누어 주면 된다. 이는 다음과 같다.
ΔSˉidealM=−k(x1lnx1+x2lnx2)
Gibbs free energy의 정의에 의해 ideal mixture의 깁스 자유 에너지의 변화량은 다음과 같다.
ΔGidealMΔGˉidealM=ΔHidealM−TΔSidealM=kT(N1lnx1+N2lnx2)=kT(x1lnx1+x2lnx2)
Flory-Huggins Theory
Polymer chain
우리가 알고 싶은 것은 small molecules가 아닌 polymer chain의 mixing이다. polymer chain은 chian connectivity가 존재한다. 즉, component를 이루는 monomer가 연결되어 있다. 그렇기에 다음 그림과 같은 양상을 띄게 된다.

이런 chain connectivity를 고려한 polymer mixing을 다룬 이론이 바로 Flory-Huggins theory이다. 우선 고분자 chain은 mixing에 의한 열의 발생이 존재한다. 이는 enthalpy에 해당한다. 또한 앞서 설명한 chian connectivity에 의한 고분자와 solvent molecules 사이의 크기의 큰 차이가 존재한다. 이것은 entropy에 영향을 줄 것이다. 즉, chain connectivity는 polymer solution에서 entropy 변화량이 lattice 내에 solvent와 polymer chain을 배치하는 경우의 수가 되게 한다.
Polymer mixing
lattice 내의 components와 component를 구성하는 molecule을 통해 경우의 수를 구하기 위해 다음과 같은 변수를 정의하자.
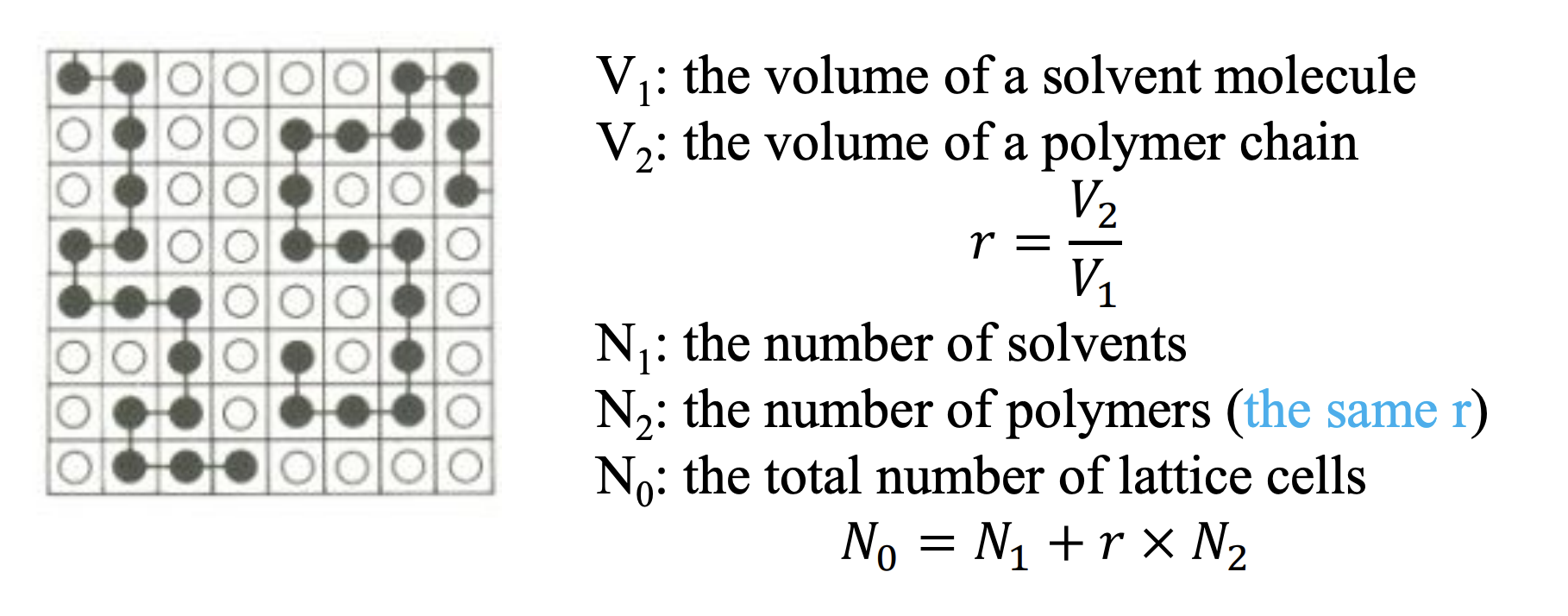
만약 i개의 polymer가 이미 lattice 내에 존재한다고 하자. 이 때 (i+1)번째 polymer가 lattice 내에 추가된다고 하면, r×i의 cell들은 고분자들이 lattice 내부에 차지하고 있을 것이다. 그럼 이 때 (i+1)번째 polymer의 첫번째 segment가 lattice 내부에 존재할 수 있는 경우의 수는
(N0−r×i)
가 된다. 두번째 segment는 첫번째 semgent의 옆에 놓일 수 있는 경우의 수가 될 것인데, 여기서 인접한 cell이 비어 있을 확률을 pi라 하자. pi는 다음과 같다.
pi=N0N0−r×i
그리고 z를 첫번째 segment에 인접한 cell의 수라 하자. 그럼 두번째 segment가 lattice 내부에 가능한 경우의 수는
z×pi=zN0(N0−r×i).
세번째 그리고 그 이후의 segment에 대한 경우의 수는
(z−1)×pi
라 하자. 그럼 (i+1)번째 고분자가 lattice에 올 수 있는 전체 경우의 수(wi)는 다음과 같다. 이 때 (i+1)th 고분자는 r개의 segment를 가진다.
wi+1=(N0−r×i)×zN0(N0−r×i)×((z−1)N0(N0−r×i))r−2=(N0−r×i)rN0z(N0(z−1))r−2≈(N0−ri)r(N0(z−1))r−1
마지막에 z를 z−1로 근사한 것이다. 위 식을 통해 lattice내에 존재하는 모둔 N2 고분자들이 lattice에 존재할 수 있는 전체 경우의 수는 다음과 같을 것이다.
w1w2w3⋯wN2=i=1∏N2wi
N2개의 고분자들이 전부 동일하다면(identical), 경우의 수를 따질 때 중복의 경우를 제거해야 하므로, 다음과 같다.
wp=N2!∏i=1N2wi
wp를 계산하기 위해 위에서 구한(근사) wi+1를 통해 wi를 나타낼 수 있다. 계산 과정은 생략하도록 하자. 최종적으로 얻은 wp의 결과는 다음과 같다.
wp=N2!∏i=1N2wi=N2!(N0z−1)N2(r−1)(rN2rN1!rN0!)r
이제 섞은 후의 entropy SM을 구해보자.
kSM=lnwp=lnN2!(N0z−1)N2(r−1)(rN2rN1!rN0!)r
여기서 lnx!=ln(x/e)x라는 가정을 사용하자. 그럼 다음과 같이 전개 된다.
kSM=lnN2!(N0z−1)N2(r−1)(rrN2rN1!rN0!)r=ln(eN2)N2(N0z−1)N2(r−1)(rrN2reN1N1/rreN0N0/r)r=ln(eN2)N2(N0z−1)N2(r−1)rrN2((N1N0)rN1(reN0)N2)r=⋯=ln((N1N0)N1(N2N0)N2(ez−1)(r−1)N2)=N1ln(N1N0)+N2ln(rN2N0)+N2((r−1)(ln(z−1)−1)+lnr)
Entropy of Polymer Mixture
이제 ΔSM을 구하기 위해, 섞기 전을 가정해보자. 섞기 전에는 pure solvent와 pure polymer만 존재할 것이다. 각각의 entropy를 위 식을 이용하여 구해보면 다음과 같다. pure solvent는 N2=0인 경우이므로,
kS1=0
pure polymer는 N1=0이므로,
kS2=N2((r−1)(ln(z−1)−1)+lnr)
그럼 kΔSM는 다음과 같다.
kΔSM=k1(SM−S1−S2)=N1ln(N1N0)+N2ln(rN2N0)=N1ln(N1N1+rN2)+N2ln(rN2N1+rN2)
여기서 mole fraction을 φ라 하자. 그럼 위 식은
kΔSM=−N1lnφ1−N2lnφ2
볼츠만 상수 k는 기체 상수 R을 아보가드로 수로 나눈 값이므로, 위 식의 양변에 아보가드로 수(Navo)를 곱해주면,
RΔSM=−n1lnφ1−n2lnφ2.
단위 개수(lattice의 개수)당 polymer mixture의 엔트로피 변화량은 어떻게 구할 수 있을까? 우선 N1의 정의를 다시 살펴보자. solvents의 개수이다. 그렇기에 전체 부피에 solvent의 몰 분율인 φ1을 곱한 것이 solvent molecule 하나의 부피가 된다. 이 값으로 solvent의 전체 부피인 V1을 나누어 주면 N1이 나올 것이다. 이는 polymer chains의 경우에도 동일할 것이고, 최종적으로 다음이 성립한다.
N1=V1φ1V;N2=V2φ2V
polymer mixture의 엔트로피 변화량 식에 위 식을 대입해주면 다음과 같다.
kΔSM=−r1V0φ1Vlnφ1−r2V0φ2Vlnφ2
where r1=V0V1 and r2=V0V2.
kΔSM=−V0V(r1φ1lnφ1+r2φ2lnφ2)
그리고 V/V0는 N의 정의를 떠올려보면, N0로 쓸수 있기에 다음과 같다.
kΔSM=−N0(r1φ1lnφ1+r2φ2lnφ2)
그럼 최종적으로 단위 개수당 polymer mixture의 엔트로피 변화량인 ΔSˉM은 다음과 같다.
kΔSˉM=−(r1φ1lnφ1+r2φ2lnφ2)
위 식을 이용해 3가지 경우의 polymer mixture의 엔트로피 변화량을 구할 수 있다.
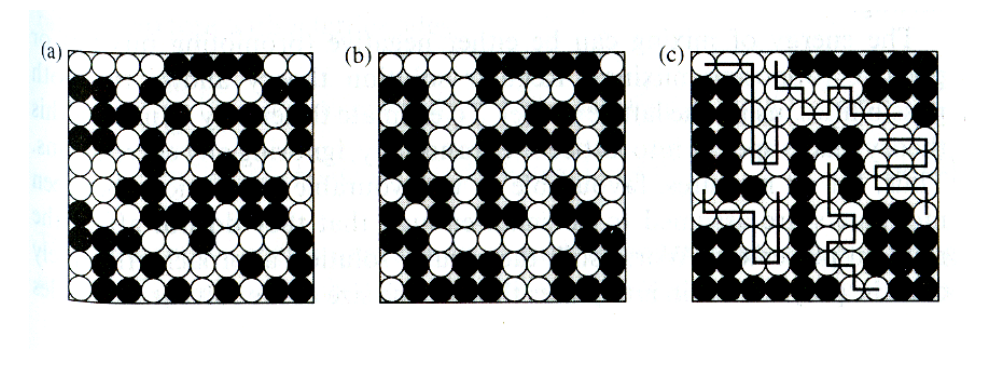
- (c) polymer blend
kΔSˉM=−(r1φ1lnφ1+r2φ2lnφ2)
- (b) polymer solution
kΔSˉM=−(φ1lnφ1+r2φ2lnφ2)
- (a) regular solution
kΔSˉM=−(φ1lnφ1+φ2lnφ2)
Gibbs Free Energy of Ideal Mixture
ideal 한 경우이기에 섞기 전/후의 interaction energy(enthalpy)의 변화가 없다. 그러므로, 깁스 자유 에너지의 변화량은 다음과 같다.
ΔGˉM=−TΔSˉM=kT(r1φ1lnφ1+r2φ2lnφ2)
자연로그 안의 값인 φ가 분율임을 생각해보면, 항상 음수가 된다는 것을 알 수 있다. 하지만 위에서 고려한 3가지 경우(polymer blend / polymer solution / regular solution)의 solution이 mixing이 선호되는 정도는 다르다. 에너지가 최소가 되어야 자발적으로 mixing이 이루어진다. 3가지 경우를 깁스 자유 에너지 식으로 plot한 결과는 아래와 같다.

plot의 결과로 polymer blend가 가장 mixing 되기 힘들고, regular solution의 경우가 가장 잘 mixing이 이루어질 것이라 예상할 수 있다.
Enthalpy of Mixture
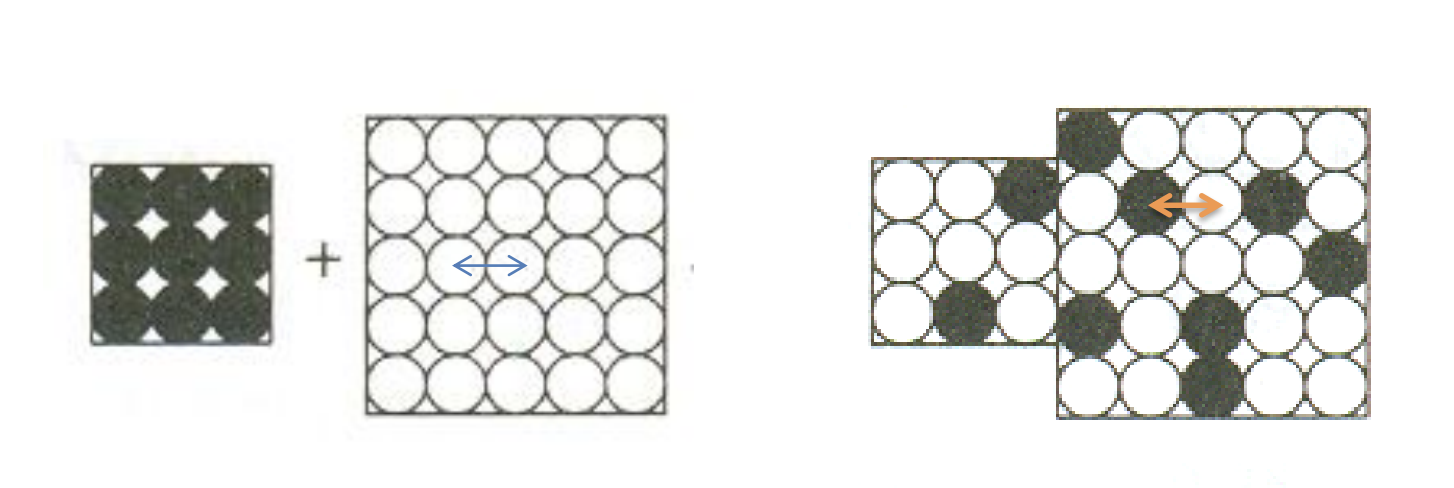
이전 chapter에서 excluded volume에 대해 배울 때, interaction energy가 enthalpy로 계산된다고 배웠다. 그렇다면 위 그림과 같은 검은색과 흰색의 lattice를 섞기 전에는 서로 다른 종끼리만 존재하기에 검은색 종의 interaction과 흰색 종의 interaction만 존재한다. 하지만 섞게 되면 검은색과 흰색 종 사이의 interaction이 새롭게 추가된다.
만약 고분자와 solvent species 사이의 interaction을 고려해본다면, 여기서 1을 polymer species, 2를 solvent species라고 하자. 그럼 서로 다른 종끼리의 충돌/접촉 시 발생하는 에너지를 계산해보자. 고분자와 고분자 간의 충돌/접촉 시 발생하는 에너지를 ε11, solvent와 solvent 간의 에너지를 ε22, 고분자와 solvent 간의 에너지를 ε12라고 하자. 섞기 전과 섞은 후의 고분자와 solvent 간의 접촉 시 발생하는 에너지의 차이 Δε12를 구해보자. 그럼 다음과 같다.
Δε12=ε12−21(ε11+ε22)
Enthalpy for a polymer chain
이제 고분자 chain 안에 존재하는 monomer를 고려해보자. 이때 우리는 인접 lattice cell에 solvent molecule가 위치할 확률을 고려해주어야 한다. 이 확률을 ϕ1이라 하자. 위 정의에 따라 mixing 전/후의 enthalpy의 변화량, ΔHm은 Δε12로 간주할 수 있었다. 하지만 지금 우리는 단순한 저분자 물질1, 2간의 mixing이 아니라 1이 solvent 2가 polymer chain인 경우를 가정한다. lattice cell model에서 polymer-solvent species의 접촉은 인접한 lattice cell에 solvent molecule이 위치할 확률 ϕ1에 의해 계산된다. 그리고 Δε12는 한 번의 서로 다른 종의 접촉에 의해 발생한다.

그러므로, 접촉 횟수를 q라고 하면, "한 개의" polymer chain의 섞은 후의 엔탈피 변화량, ΔHm은 qΔε12로 계산된다.
ΔHM=qΔε12
여기서 q는 위에서 설명했듯이, lattice model에서 solvent molecule이 polymer chain의 monomer의 인접 lattice cell에 위치할 확률 ϕ1에 의해 계산된 polymer-solvent 사이의 충돌/접촉 횟수이다. 각 monomer는 lattice model에서 비어 있는 cell의 개수를 z라고 하면, ϕ1z개의 solvent molecules로 둘러싸인다. 그렇다면 polymer chain 하나는 solvent molecules로 ϕ1zr개의 solvent molecules로 둘러싸인다. 그러므로 q=ϕ1rz가 되고, 최종적으로 enthalpy의 변화량은 다음과 같다.
ΔHM=ϕ1rzΔε12
Enthalpy for polymer chains
이제는 N2개의 polymer chian를 섞게 된 후의 enthalpy 변화량을 구해보자. 다를 것은 없고 위에서 구한 polymer-solvent 사이의 충돌/접촉 횟수인 q에 N2를 단순히 곱해주기만 하면된다.
ΔHM=N2ϕ1rzΔε12
lattice model에서 N1,N2는 전체 lattice 중 1번째 종(solvent)와 2번째 종(polymer)가 차지하는 lattice cell의 개수이고, ϕ1,ϕ2는 각 종의 부피 분율(volume fraction)이다. 이를 고려하면(r은 V2/V1이였다.), 다음과 같은 식이 성립한다.
N1rN2=ϕ1ϕ2→rN2ϕ1=N1ϕ2
위 식을 ΔHM에 대입해주면,
ΔHMwhere kTχ1=N1ϕ2zΔε12=kTχ1N1ϕ2=zΔε12
여기서 1몰 당 엔탈피의 변화량을 구하고 싶다면, 양변을 N0로 나누어 주면 된다.
ΔHˉM=kTχ1N0N1ϕ2=kTχ1ϕ1ϕ2
χ1
갑자기 χ1이라는 물리량이 등장했다. 우리는 고분자와 용매 분자 간의 상호작용 에너지를 ε12로 나타냈었다. Flory-Huggins Theory에서 χ는 고분자와 용매 사이의 비이상적인 거동을 나타내는 매개변수로, 통계 역학 이론을 통해 계산된다.
χ=kTzΔε12
로 구해지며, k,T는 각각 볼츠만 상수와 절대온도이다. 그렇기에 polymer solution에서 ΔHM을 구할 때, zΔε12=kTχ1라는 식이 등장했다.
그렇다면, χ가 왜 비이상적인 거동을 나타낼까? 서로 다른 종의 이상적인(ideal)한 경우에는 섞기 전 서로 다른 두 종 사이의 interaction energy의 평균이 섞은 후 두 종 사이에서 발생하는 interaction energy와 같을 것이다.
ε12=21(ε11+ε22) for ideal case
이렇게 되면, 다음이 성립한다.
Δε12=0→χ=0
흡열 반응(ΔH>0)인 경우는 다음과 같다.
ε12>21(ε11+ε22) for endothermic case
이렇게 되면, 다음이 성립한다.
Δε12>0→χ>0
발열 반응(ΔH<0)인 경우는 다음과 같다.
ε12<21(ε11+ε22) for exothermic case
이렇게 되면, 다음이 성립한다.
Δε12<0→χ<0
열역학적 관점에서는 자발적인 mixing은 ΔH<0인 발열 반응에서 잘 이루어지기 때문에, Δε12,χ가 0보다 작은 경우 mixing이 잘 일어난다고 볼 수 있다.
Gibbs Free Energy of Polymer Solution
깁스 자유 에너지의 정의에 의해 다음과 같다.
ΔGˉM=ΔHˉM−TΔSˉM
이 식에 Florry-Huggins의 lattice model로 유도된 enthalpy term과 entropy term을 대입해주면 다음과 같다.
ΔGˉM=kTχ1ϕ1ϕ2+kT(r1ϕ1lnϕ1+r2ϕ2lnϕ2)=kT(r11−ϕ2ln(1−ϕ2)+r2ϕ2lnϕ2+χ1(1−ϕ2)ϕ2)
고분자 용액(polymer solution)의 경우에는, r1=1이므로
ΔGˉM=kT((1−ϕ2)ln(1−ϕ2)+r2ϕ2lnϕ2+χ1(1−ϕ2)ϕ2)
이다. 위 식이 바로 Flory-Huggins Equation이다.
F-H equation에서 ϕ2는 부피 분율이므로 1보다 항상 작다. 그러므로 위 식에서 ln을 포함하는 항들은 전부 음수가 된다. 그러므로 엔탈피와 관련된 항인 χ를 포함한 항은 χ 값에 따라 음수일수도 양수일수도 있다.
Limitation of Flory-Huggins Theory
Flory-Huggins theory는 엔탈피와 엔트로피의 계산에서 lattice model을 가정하였다. 하지만 lattice model에서 lattice cell은 전부 uniform한 밀도를 갖는다고 가정했다. 또한 섞은 후의 부피 변화가 없다고 가정했으며, 고분자가 mixing되면서 발생하는 배열(arrangement)를 고려하지 않았다. 또한 고분자와 용매 사이의 interaction을 의미하는 매개변수 χ는 구성(composition)을 반영하지 않는 독립적인 변수이다. 가장 중요한 점은 엔트로피의 계산에서 segment가 위치하게 될 때를 온전히 확률로 계산했다. 그렇기에 완전히 random한 경우로 Δε12=0일 때, 위 계산이 맞아떨어진다. 그러므로 실제 mixing에서 발생하는 여러 interaction을 고려하지 않은 combinational entropy를 구한 것이다.
Non-Combinational entropy contribution
이제 이상적인 경우를 상정한 combinatorial entropy가 아닌 실제 interaction의 경우를 고려한 non-combinatorial entropy를 고려해보자. 이상적이지 않은 경우이므로 segment가 위치할 수 있는 경우의 수가 더 줄어들게 될 것이므로, entropy term도 마찬가지로 감소할 것이다. 즉, non-combinatorial entropy ΔSM는 combiational entropy보다 더 감소하게 된다. 하지만 non-combinational entropy를 직접 구하기엔 복잡하기에 다음 과정을 통해 non-combinatorial contribution을 반영한다.
non-combinatorial entropy는 Flory-Huggins theory에서 이상적인 경우를 가정하고 구한 combinatorial entropy보다 더 작은 값을 갖게 된다. 그러므로 polymer solution의 깁스 자유 에너지의 변화량, ΔGM은 증가하게 된다. 그렇다면, non-combinatorial entropy를 직접적으로 계산하지 않고, enthalpy term의 ΔHM이 χS라는 값에 의해 증가한다고 가정하자.
χ1=χH+χS
즉, enthalpy term은 χ1이라는 값과 관계가 있으므로 기존의 polymer-solvent의 interaction enenrgy(ε12)로 구한 χ값 χH라고 하고, non-combinatorial의 경우에서 실제 가능한 segment의 경우의 수가 감소로 인한 entropy term의 감소로 이를 완충하기 위해 χS항이 추가된 것이다. 이는 다음과 같이 쓸 수 있으며,
kTχ1=zΔε12=z(Δε12,H−TΔε12,S)
χ1에 대해 정리하면, 다음과 같다.
χ1=kTzΔε12,H−kzΔε12,S
여기서 Δε12,S을 포함한 항은 T를 포함하고 있지 않다. 즉 온도에 대해 독립적인 항임을 의미한다. 간략하게 표현하면,
χ1=TB+A(≈0.34)
가 된다.